Caractéristiques gazeuses de l'État, loi générale, exemples

- 1134
- 198
- Anaïs Julien
Il État gazeux Il s'agit d'un état d'agrégation du sujet dans lequel les particules sont maintenues ensemble par des interactions faibles, pouvoir se déplacer dans toutes les directions du récipient qui les contient. De tous les états physiques du sujet, le gazeux est celui qui manifeste la plus grande liberté et chaos.
Les gaz exercent la pression, transportent la chaleur et sont composés de tout type de petites particules. Notre atmosphère et l'air que nous respirons est une manifestation de l'état gazeux ici sur terre.
 Dans les émanations de fumée, le comportement des gaz peut être observé avant de se disperser à travers l'atmosphère. Source: Pexels.
Dans les émanations de fumée, le comportement des gaz peut être observé avant de se disperser à travers l'atmosphère. Source: Pexels. Les exemples de gaz sont des gaz à effet de serre, tels que la vapeur d'eau, le dioxyde de carbone, le méthane ou l'ozone. Le dioxyde de carbone que nous expirons dans la respiration est un autre exemple de substance gazeuse.
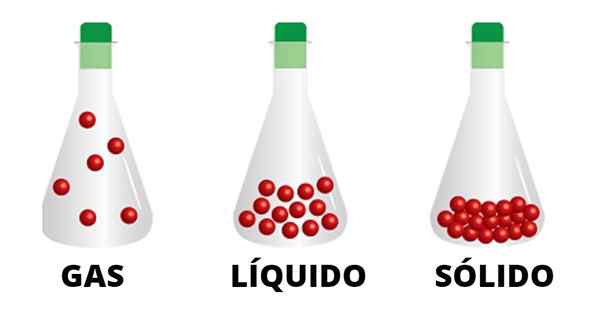 Les particules gazeuses sont liées par de faibles interactions et se déplacent par le conteneur. Il est observé que les particules de l'état liquide sont plus uni et celles du solide étroitement lié
Les particules gazeuses sont liées par de faibles interactions et se déplacent par le conteneur. Il est observé que les particules de l'état liquide sont plus uni et celles du solide étroitement lié Les liquides et les solides, par exemple, ne passeront pas à des positions au-delà de leurs propres limites de matériau, un fait qui ne se produit pas avec les gaz. La fumée des cigarettes, des cheminées et des tours, montrent par eux-mêmes comment le gaz monte et dispersé par l'environnement sans rien l'arrêter.
[TOC]
Caractéristiques de l'état gazeux
Il manque de volume ou de forme
L'état gazeux se caractérise par le fait de ne pas avoir de forme ou de volume défini. S'il n'y a pas de frontières pour la conserver, elle se dispersera tout au long de l'atmosphère. Même comme pour l'hélium, il s'échappera à l'extérieur de la terre.
Un gaz ne peut acquérir la forme imposée par un récipient. Si un récipient est cylindrique, le gaz "aura" la forme du cylindre.
Peut vous servir: calorimétrie: quelles études et applicationsMauvais conducteur de chaleur
Cet état se caractérise également par un mauvais conducteur de la chaleur et de l'électricité. En général, il est moins dense par rapport aux états solides et liquides.
Parce que la plupart des gaz sont incolores, comme l'oxygène et le dioxyde de carbone, il peut être déterminé à quel point il y a dans un conteneur au moyen de la mesure de leur pression.
Réactifs
Les gaz ont tendance à être plus réactifs, à l'exception des gaz nobles, que des liquides ou solides.
Petites particules
Les particules gazeuses sont également généralement petites, étant des atomes ou des molécules simples.
Par exemple, hydrogène gazeux, h2, C'est une très petite molécule formée par deux atomes d'hydrogène. Nous avons également l'hélium, lui, dont les atomes sont encore plus petits.
Interactions
Les interactions à l'état gazeux sont méprisables. Ceci est très différent des états liquides et solides, dans lesquels leurs particules sont très cohésives et interagissent fortement les unes des autres. Dans les molécules qui forment les états liquides et solides, il n'y a pratiquement aucun vide moléculaire parmi eux.
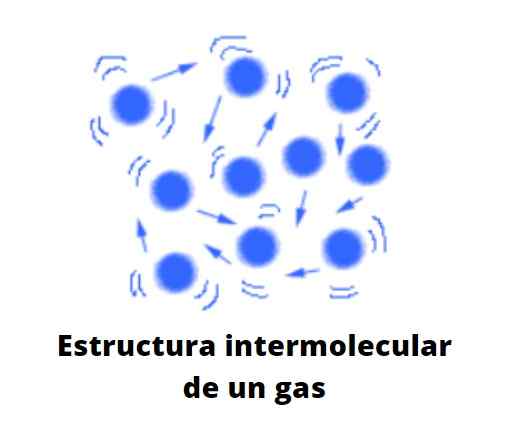
Les particules à l'état gazeux sont très distanciées l'une des autres, il y a beaucoup de vide entre eux. Ce n'est plus un vide à l'échelle moléculaire. La distance qui les sépare est tellement, que chaque particule dans le gaz est libre, indifférente à son environnement, à moins que dans sa trajectoire chaotique ne monte avec une autre particule ou contre la paroi du récipient.
Peut vous servir: solution diluéeS'il est supposé qu'il n'y a pas de conteneur, le vide entre les particules de gaz peut être occupé par l'air, ce qui pousse et traîne le gaz vers la direction de son courant. C'est pourquoi l'air, qui se compose d'un mélange gazeux, est capable de déformer et de répandre les substances gazeuses, tant qu'elles ne sont pas beaucoup plus denses que lui.
Loi de l'État gazeux générale
L'étude expérimentale du comportement et de la mécanique des gaz a abouti à plusieurs lois (Boyle, Charles, Gay-Lussac) qui combinent pour prédire quels seront les paramètres de tout système de gaz ou phénomène, c'est-à-dire quelle sera sa température, son volume, volume et pression.
Cette loi générale a l'expression mathématique suivante:
P = kt / v
Où k est une constante, p la pression et le volume, et t la température du gaz à l'échelle de Kelvin. Ainsi, connaissant deux variables (pour dire, P et V), le troisième peut être effacé, ce qui serait l'inconnu (T).
Cette loi permet, par exemple, quelle devrait être la température d'un gaz, verrouillé dans un conteneur de volume V, pour afficher une pression P.
Si nous ajoutons la contribution d'Amadeus Avogadro à cette loi, nous aurons alors la loi idéale sur les gaz, qui implique également le nombre de particules, et avec eux la concentration molaire du gaz:
P = nrt / v
Où n correspond au nombre de moles de gaz. L'équation peut être réécrite comme:
P = CRT
Où c C'est la concentration molaire de gaz (n/ V). Ainsi, à partir d'une loi générale, la loi idéale est obtenue qui décrit comment la pression, la concentration, la température et le volume d'un gaz idéal.
Peut vous servir: tamiséExemples d'état gazeux
Éléments gazeux
Le même tableau périodique offre un bon répertoire d'exemples d'éléments présentés sur Terre comme des gaz. Entre eux nous avons:
-Hydrogène

-Hélium
-Azote
-Oxygène
-Fluor
-Chlore
-Néon
-Argon
-Kripton
-Xénon
Cela ne signifie pas que d'autres éléments ne peuvent pas devenir gazeux. Par exemple, les métaux peuvent être transformés en gaz s'ils sont soumis à des températures plus élevées que leurs points d'ébullition respectifs. Ainsi, il peut y avoir des gaz de fer, de mercure, d'argent, d'or, de cuivre, de circonférences, d'iridium, de particules d'osmio; de tout métal.
Composés gazeux
Dans la liste suivante, nous avons quelques exemples de composés gazeux:
-Monoxyde de carbone, CO
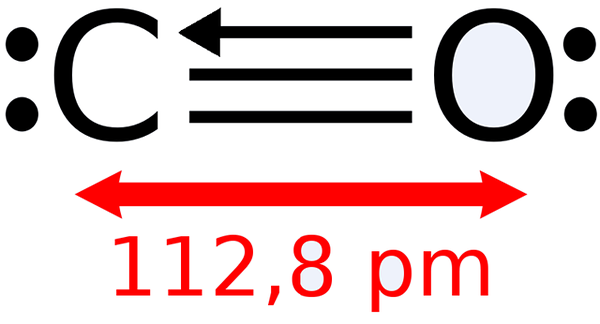 Structure Lewis du monoxyde de carbone
Structure Lewis du monoxyde de carbone -Dioxyde de carbone, CO2 (Gas qui forme nos exhalations)
-Ammoniac, NH3 (substance vitale pour les processus industriels symphines)
-Trioxyde de soufre, donc3
-Méthane, ch4 (gaz domestique, avec lequel il est cuit)
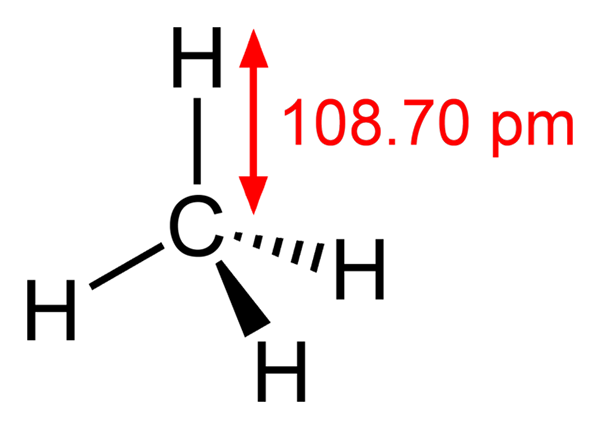 Structure de méthane
Structure de méthane -Etano, ch3Ch3
-Dioxyde d'azote, non2 (gaz de coloration marron)
-Phosgen, Cocl2 (substance hautement toxique)
-Air (étant un mélange d'azote, d'oxygène, d'argon et d'autres gaz)
-Vapeur d'eau, h2Ou (qui fait partie des nuages, des géisseurs, des vaporisateurs de machines, etc.).
-Acétylène, hc≡ch
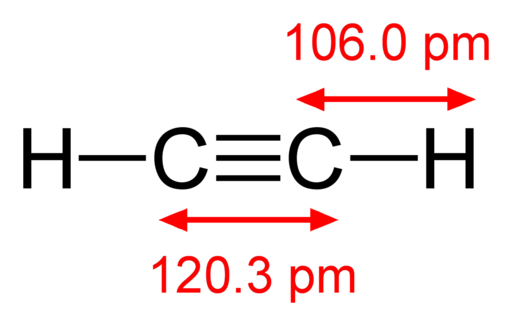 Formule structurelle de l'acétylène
Formule structurelle de l'acétylène -Vapeurs d'iode, je2 (Gas de couleur violette)
-Hexafluoruro de soufre, SF6 (gaz très dense et lourd)
-Hydrazine, n2H4
-Le chlorure d'hydrogène, HCl (qui s'est dissous dans l'eau produit de l'acide chlorhydrique)
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2020). Gaz. Récupéré de: dans.Wikipédia.org
- Edward A. le maçon. (6 février 2020). Gaz. Encyclopædia Britannica. Récupéré de: Britannica.com
- Helmestine, Anne Marie, Ph.D. (11 février 2020). Définition et exemple de gaz en chimie. Récupéré de: Thoughtco.com
- María Estela Raffino. (12 février 2020). Quel est l'état gazeux? Récupéré de: concept.de

