Enthalpie de réaction, thermochimie, exercices

- 1804
- 334
- Raphaël Charles
La Enthalpie de réaction Il s'agit d'une fonction thermodynamique qui vous permet de calculer la chaleur acquise ou délivrée à une réaction chimique, à condition que cette réaction se soit produite à une pression constante. Il est défini comme l'énergie interne ou plus le produit de la pression P par le volume V des substances impliquées dans une réaction chimique, comme suit: H = U + P ∙ V
Par conséquent, l'enthalpie a des dimensions d'énergie, et dans le système international de mesures, il est mesuré en joules. Pour comprendre la relation de l'enthalpie avec la chaleur échangée dans une réaction chimique, il est nécessaire de se souvenir de la première loi de la thermodynamique, qui établit ce qui suit: Q = ΔU + W
 Figure 1. Dans la combustion d'un gaz, l'enthalpie diminue. Source: Pixabay
Figure 1. Dans la combustion d'un gaz, l'enthalpie diminue. Source: Pixabay La première loi établit que la chaleur échangée dans un processus thermodynamique est égale à la variation de l'énergie interne des substances impliquées dans le processus plus les travaux effectués par ces substances dans le processus.
Dans tout processus, le travail est calculé par la relation suivante:
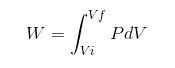
Dans l'expression précédente VI est le volume initial, vf le volume final et p la pression. Si le processus est effectué sous pression constante P, alors les travaux résultants seront:
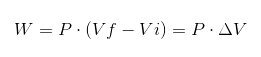
Où ΔV est la variation de volume.
[TOC]
Définition
Les réactions chimiques sont des processus thermodynamiques qui se produisent généralement sous pression constante et très fréquemment à la pression atmosphérique. Ce type de processus thermodynamiques est appelé "isobare", car il se produit à pression constante.
Dans ce cas, la première loi de la thermodynamique peut être écrite comme ceci:
QP = ΔU + P ∙ ΔV
Où QP indique que la chaleur a été échangée à une pression constante. Si la définition de l'enthalpie h = u + p ∙ v obtenue alors:
QP = ΔH
De là, vous devez changer l'enthalpie positive indique une réaction qui a pris la chaleur de l'environnement. C'est une réaction endothermique.
Peut vous servir: ton: transformations, équivalences et exercices résolusAu contraire, si le changement d'enthalpie est négatif, c'est alors une réaction exothermique.
En fait, le mot enthalpie vient du mot grec Enthalpien, dont le sens est "chaleur".
Souvent, l'enthalpie est également appelée chaleur. Mais il doit être clair que ce n'est pas la même chose que la chaleur, mais c'est l'échange de chaleur pendant le processus thermodynamique qui change l'enthalpie.
Relation de chaleur
Contrairement à la chaleur, l'enthalpie est une fonction d'état. Lorsque le changement d'enthalpie est calculé, la différence de deux fonctions qui dépendent exclusivement de l'état du système tel que l'énergie et le volume internes sont en cours.
ΔH = ΔU + P ∙ ΔV
Comme dans la réaction, la pression reste constante, donc l'enthalpie de réaction est une fonction d'état qui ne dépend que de l'énergie et du volume internes.
Dans une réaction chimique, l'enthalpie des réactifs peut être définie comme la somme de celle de chacun d'eux; et celui des produits comme la somme de l'enthalpie de tous les produits.
Le changement d'enthalpie dans une réaction est la différence de celle des produits sauf celle des réactifs:
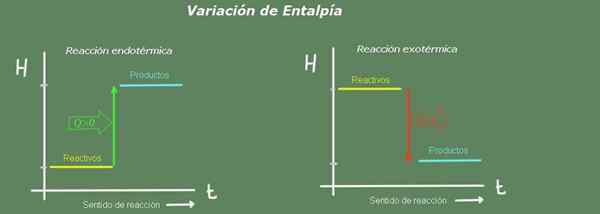 Figure 2. Diagramme d'enthalpie. Source: auto-faite.
Figure 2. Diagramme d'enthalpie. Source: auto-faite. Dans une réaction endothermique, l'enthalpie des produits est supérieure à celle des réactifs; c'est-à-dire que la réaction prend la chaleur de l'environnement. Au contraire, dans une réaction exothermique, l'enthalpie des réactifs est supérieure à celle des produits, car la réaction donne de la chaleur à l'environnement.
Enthalpie standard
Comme le changement d'enthalpie dans une réaction chimique peut dépendre de la pression et de la température, il est habituel de définir les conditions de réaction standard:
Il peut vous servir: Courbe d'étalonnage: à quoi sert-il, comment le faire, des exemplesTempérature de réaction standard: 25 ° C.
Pression de réaction standard: 1 atm = 1 bar.
L'enthalpie standard est indiquée comme suit: H °
Thermochimie
Dans une équation thermochimique non seulement des réactifs et des produits, la variation de l'enthalpie est également importante. L'enthalpie est comprise comme la réaction au changement d'elle qui avait lieu pendant la même chose.
Par exemple, voyons les réactions suivantes:
2 H2 (gaz) + O2 (gaz) → 2 H2O (liquide); ΔH ° = -571,6 kJ (exothermique).
H2 (gaz) + (½) O2 (gaz) → H2O (liquide); ΔH ° = -285,8 kJ (exothermique).
2 H2O (liquide) → 2 H2 (gaz) + O2 (gaz); ΔH ° = +571,6 kJ (endothermique).
L'enthalpie est une quantité thermodynamique étendue
Si les termes d'une équation chimique sont multipliés ou divisés par un certain facteur, alors l'enthalpie est multipliée ou divisée par elle.
Si la réaction est investie, alors le signe de l'enthalpie de réaction est également investi.
Exercices résolus
-Exercice 1
Le gaz acétylène C2H2 est obtenu à partir de la réaction de carbure de calcium CAC2 qui se présente de manière granulée avec de l'eau à l'environnement et à la pression environnementale.
En tant que données, il existe des enthalpies de formation de réactifs:
ΔH ° (CAC2) = -59,0 kJ / mol
ΔH ° (H20) = -285,8 kJ / mol
Et l'enthalpie de la formation de produits:
ΔH ° (C2H2) = +227,0 kJ / mol
ΔH ° (CA (OH) 2) = -986,0 kJ / mol
Trouvez l'entropie standard de la réaction.
Solution
La première chose est d'élever l'équation chimique équilibrée:
CAC2 (S) + 2H20 (L) → CA (OH) 2 (S) + C2H2 (G)
Et maintenant les enthalpies des réactifs, des produits et de la réaction:
- Réactifs: -59,0 kJ / mol -2 ∙ 285,8 kJ / mol = -630,6 kJ / mol
- Produits: -986,0 kJ / mol + 227,0 kJ / mol = -759 kJ / mol
Il peut vous servir: quels sont les vecteurs coplanares? (Avec des exercices résolus)- Réaction: ΔH ° = -759 kJ / mol - (- 630 kJ / mol) = -129 kJ / mol
C'est une réaction exothermique.
-Exercice 2
Lorsque 1 litre d'acétylène brûle dans des conditions standard, combien de chaleur se détache-t-elle?
Solution
La réaction de combustion de l'acétylène une fois équilibrée est comme ceci:
C2H2 (G) + (5/2) O2 (G) → 2 CO2 (G) + H20 (L)
Nous avons besoin d'enthalpies de la formation sur les produits:
ΔH ° (CO2) = -393,5 kJ / mol
ΔH ° (H2O (L)) = -285,8 kJ / mol
Calcul des enthalpies
Avec ces données, nous pouvons calculer l'enthalpie des produits:
ΔH ° (produits) = 2 * (- 393,5 kJ / mol) + (-285,8 kJ / mol) = -1072,8 kJ / mol
Et l'enthalpie de la formation des réactifs:
ΔH ° (C2H2) = 227,0 kJ / mol
ΔH ° (O2) = 0,0 kJ / mol
L'enthalpie des réactifs sera:
227,0 kJ / mol + (5/2) * 0,0 = 227,0 kJ / mol
L'enthalpie de la réaction molaire sera alors: ΔH ° (produits) - ΔH ° (réactifs) = -1072.8kj / mol - 227,0 kJ / mol = -1299,8 kJ / mol
Enthalpie de combustion
Maintenant, nous devons savoir combien de moles d'acétylène sont un litre d'acétylène dans des conditions standard. Pour cela, nous utiliserons l'équation d'état d'un gaz idéal, à partir de laquelle nous effacerons le nombre de moles.
Nombre de moles n = p * v / (r * t)
P = 1 atm = 1,013 x 10⁵ PA
V = 1 l = 1,0 x 10 ^ -3 m³
R = 8,31 J / (mol * k)
T = 25 ° C = 298,15 K
N = 0,041 mol
L'enthalpie de la combustion de 1 litre d'acétylène est de 0,041 mol * (-129,8 kJ / mol) = -53,13 kJ
Le signe négatif indique qu'il s'agit d'une réaction exothermique qui dégage 53,13 kJ = 12,69 kcal.
Les références
- Castaños e. Enthalpie dans les réactions chimiques. Récupéré de: lidiaconlachimica.Wordpress.com
- Thermochimie. Enthalpie de réaction. Récupéré de: Ressources.éducation.est
- Thermochimie. Définition de l'enthalpie de réaction standard. Récupéré de: Quimitube.com
- Wikipédia. Enthalpie de réaction standard. Récupéré de: Wikipedia.com
- Wikipédia. Enthalpie de formation. Récupéré de: Wikipedia.com
- « Formules d'erreur relatives, comment il est calculé, exerce
- Quel est l'effort d'affectation et comment l'obtenir? »

