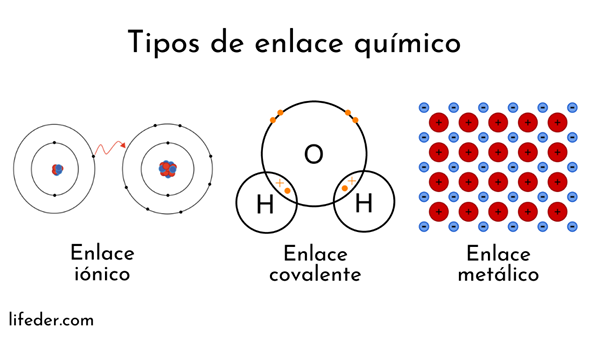
Liaison chimique
- 1843
- 54
- Lucas Schneider
Nous expliquons quels sont les liens chimiques, les types qui existent et nous donnons de nombreux exemples
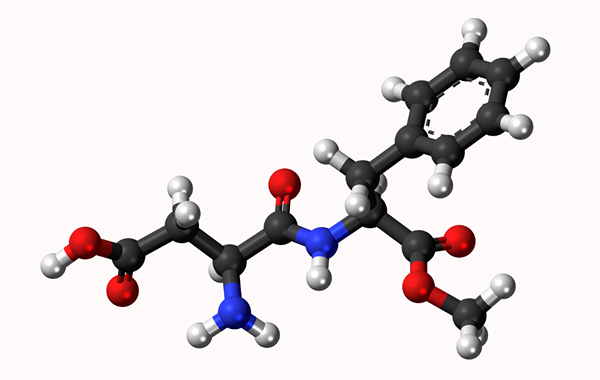
 Modèle moléculaire d'Aspartamo: lien simple représenté par une ligne et une double liaison par deux lignes. Les balles sont des atomes
Modèle moléculaire d'Aspartamo: lien simple représenté par une ligne et une double liaison par deux lignes. Les balles sont des atomes Qu'est-ce qu'une liaison chimique?
UN Liaison chimique C'est la force qui maintient avec les atomes d'un composé. La force qui unit les atomes est électromagnétique, et lorsque les atomes sont liés, ils conservent leur propre nature.
Par exemple, de l'eau commune est formée en raison de l'union de deux atomes d'hydrogène (H2) et un d'oxygène (O); C'est pourquoi sa formule chimique est h2SOIT. Bien qu'ils soient unis pour former de l'eau, les atomes d'hydrogène restent l'hydrogène et l'oxygène est toujours de l'oxygène.
Rappelons que les atomes sont formés par un noyau entouré d'un nuage d'électrons, qui ont une charge négative. Le noyau de l'atome a une charge positive, qui parvient à attirer des électrons.
Cependant, les électrons sont également attirés par les noyaux d'autres atomes. C'est ainsi que se forment des liens chimiques. Le fait que les atomes rendent ou partagent des électrons génèrent les différents types de liens chimiques.
Dans les liaisons chimiques, les atomes donnent, gagnent ou partagent des électrons de ce qu'on appelle la couche de valence, qui est la couche la plus externe d'un atome où se produit la réactivité ou la tendance à former des liaisons chimiques.
Ces liens font de nouvelles substances (pas des mélanges) qui ne peuvent pas être séparées par le biais de techniques telles que le tamis ou le filtrage.
Types de liaisons chimiques
Les atomes sont formés par un noyau (avec charge électrique positive) et des électrons (particules avec charge électrique négative) qui tournent autour. Les deux parties interviennent dans des liaisons chimiques.
Les liaisons chimiques impliquant des noyaux atomiques sont appelées métalliques. D'un autre côté, ceux impliquant l'échange d'électrons sont divisés en ion et covalent.
Peut vous servir: chlorobenzène (C6H5CL)Liens ioniques
Ce type de lien est très résistant; produit des composés chimiques solides (cristaux) dans l'eau et avec un point de fusion élevé (entre 300 et 1.000 degrés Celsius). Dissous dans l'eau, ce sont des conducteurs d'électricité.
Comment sont les liens ioniques?

Les liaisons ioniques se produisent entre un métal et un non-métal qui ont une électronégativité différente (capacité à attirer des électrons). Les électrons de la couche de Valencia d'un atome passent à l'autre atome de Valence. Qui est le même; Un atome métallique donne un électron à un atome non métallique, atteignant la stabilité électronique.
Tout au long des ions de processus de formation de liens (cations et anions) se forment, d'où le nom de liaison ionique.
Un exemple de ce type de liaison est le chlorure de sodium: ce composé chimique est formé lorsque le chlore (CL) attire l'électron de la couche de valence qui a l'atome de sodium (NA).
Un autre exemple est le chlorure de manganèse (MGC), qui est utilisé dans la fabrication de peintures et de désinfectants. À la suite de la liaison chimique, les électrons de l'atome de manganèse sont absorbés par l'atome de chlore.
Liens covalents
Les liaisons covalentes sont très dures et génèrent des composés chimiques insolubles avec une température de fusion élevée (plus de 1.000 degrés Celsius). Ils ne conduisent pas l'électricité.
Selon la manière dont les atomes partagent leurs électrons, les liaisons covalentes peuvent être:
- Simple: Ils partagent quelques électrons (A-A).
- Double: Partagez deux paires d'électrons (a =).
- Tripler: Partagez trois paires d'électrons (A≡A).
Comment former les liaisons covalentes?

La liaison covalente est formée lorsque deux éléments non métalliques partagent des électrons de leur couche de valence.
Il peut vous servir: Rubidio: Historique, propriétés, structure, obtention, utilisationsL'échange d'électrons se produit toujours de telle manière qu'il est conforme à la loi sur les octets. Ceci est un principe chimique qui indique que la configuration la plus stable pour un atome est celle dans laquelle il a huit électrons dans sa couche la plus à l'extérieur.
Un exemple de liaison covalente est l'eau (h2SOIT). Pour créer la molécule d'eau, deux liaisons covalentes simples sont nécessaires. Dans une liaison simple, l'électron hydrogène est partagé avec l'oxygène, et l'oxygène partage un électron avec de l'hydrogène.
Un autre exemple de liaison covalente est le dioxyde de carbone (CO2), l'un des principaux responsables de l'effet de serre et du changement climatique. Pour former ce composé, le carbone et l'oxygène créent deux doubles liaisons, c'est-à-dire pour chaque lien, deux paires d'électrons partagent.
Liens métalliques
Ce type de lien ne se produit que dans les éléments métalliques. Il se compose de l'union des noyaux de deux atomes du même élément métallique avec leurs électrons.
Les liaisons métalliques sont caractérisées par des conducteurs d'électricité efficaces, ayant un point de fusion et d'ébullition très élevé, et facilement oxydé. Ils sont également malléables et résistants aux rayures, très solides et forts.
Comment sont les liens métalliques?
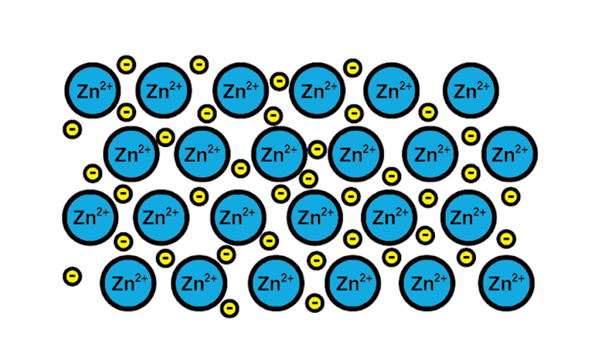 Lien métallique zinc
Lien métallique zinc Un exemple de lien métallique est celui du zinc, un élément métallique. Le processus de formation de ce type de lien est:
1-A Le noyau atomique d'un élément métallique rencontre un autre noyau du même élément.
2-Les électrons de la couche de Valencia des deux noyaux deviennent une mer d'électrons autour. C'est-à-dire qu'ils n'orbitsent pas un seul noyau atomique.
3-Les charges positives des noyaux atomiques et les négatifs des électrons sont attirés. Le résultat est des électrons de valence qui forment la mer d'électrons autour des noyaux atomiques (cations).
Il peut vous servir: sulfate de cuivre (CUSO4): structure, propriétés, obtention, utilisationsExemples de liaison chimique
Liens ioniques
- Oxyde de baryum (Bao).
- Chlorure de magnésium (MGCL2).
- Oxyde de calcium (CAO)
- Nitrate d'argent (Agno3)
- Hydroxyde de zinc (ZNOH2)
- Bromure de potassium (KBR)
- Carbonate de calcium (CACO3)
- Sulfate de cuivre (Cuo4)
- Fluorure de lithium (LIF)
- Chlorure de manganèse (MNCL2)
- Sulfate de potassium (k2Swin4)
- Oxyde de fer (moche)
- Phosphate de disodium (Na2HPO4)
- Ioduro de potassium (Ki)
Liens covalents
- Dioxyde de carbone (CO2)
- Ammoniac (NH3)
- Paraffine (CNH2N + 2)
- Diesel (c12H26)
- Dibromo (br2)
- Monoxyde de carbone (CO)
- Butano (c4Hdix)
- Benzène (c6H6)
- Azote moléculaire (n2)
- Méthane (ch4)
- Acide chlorhydrique (HCL)
- Acide cyanhydrique (HCN)
Liens métalliques
Tout métal dans son état pur est un exemple de lien métallique, à savoir:
- Nickel (ni)
- Fer (foi)
- Aluminium (AL)
- Titane (Ti)
- Plomb (PB)
- Cobalt (CO)
- Cuivre (Cu)
- Zinc (Zn)
- Mercure (HG)
- Or (AU)
- Silver (AG)
- Barium (BA)
Importance des liaisons chimiques
L'importance des liaisons chimiques est qu'elles forment des molécules organiques et inorganiques, et de cette manière ils font partie de la base de tous les organismes vivants. S'ils sont soumis à certaines conditions, ces liens peuvent être rompus. Cette énergie est appelée Lier l'énergie.
Certaines des techniques pour briser les liens sont appliquées par l'électricité, des températures élevées ou des réactions chimiques provocantes avec différents composés.
Par exemple, pour séparer l'oxygène et les molécules d'hydrogène de H2Ou, nous pouvons appliquer de l'électricité sur l'eau, qui est le processus appelé électrolyse.
Les composés chimiques formés par Link sont nombreux et sont présents dans la vie quotidienne. Le sel que nous utilisons pour assaisonner les aliments est un produit composé chimique du lien entre un atome de sodium (NA) et un chlore (CL) (CL). Sa formule chimique est NaCl, qui lit du chlorure de sodium.

