Quel est l'élément le plus électronégatif et pourquoi?

- 3417
- 579
- Raphaël Meyer
 L'élément le plus électronégatif est le fluorure (F), verrouillé dans le cercle rouge
L'élément le plus électronégatif est le fluorure (F), verrouillé dans le cercle rouge Il plus élément électronégatif Dans le tableau périodique, c'est le fluor, dont le produit chimique est F et appartient au groupe halogène. Parmi tous les éléments du tableau périodique, le fluorure est le plus soucieux de capturer les électrons d'autres atomes.
Cet élément, gazeux à température ambiante, est très réactif et il n'est donc pas facile de le trouver dans un état pur dans la nature. Le fluor est facilement lié à d'autres éléments tels que le soufre, le calcium et les métaux, ainsi que de nombreux composés, en particulier ceux contenant de l'hydrogène.
Sa haute électronégativité vous permet même de se combiner avec des gaz nobles tels que le xénon, le kripton et le radon.
Après le fluor, l'oxygène est le deuxième élément avec l'électronégativité la plus élevée. En revanche, les éléments avec l'électronégativité la plus faible sont Francio (FR) et le césium (CS).
 Parce que c'est l'élément le plus électronégatif, le fluor forme de nombreux composés, tels que le fluorite ou le fluorure de calcium. Source: Wikimedia Commons
Parce que c'est l'élément le plus électronégatif, le fluor forme de nombreux composés, tels que le fluorite ou le fluorure de calcium. Source: Wikimedia Commons Ce sont donc le plus électropositif qui existent, bien que Francio soit radioactif et très peu abondant de nature.
Électronégativité et table périodique
L'échelle de l'électronégativité a été développée par le chimiste et le prix Nobel Linus Pauling (1901-1994), bien que le concept soit dû au chimiste suédois Jöns Jakob Berzelius (1779-1848).
L'échelle Pauling, qui attribue des valeurs numériques dimensionnelles à l'électronégativité, est utilisée pour mesurer l'intensité avec laquelle un atome attire l'électron d'un autre atome différent, et ainsi former des liens.
Chaque élément a sa propre électronégativité, qui dépend de ses propriétés atomiques. Il est déterminé expérimentalement et indirectement, par exemple, la mesure de l'énergie du lien, comme Pauling l'a fait vers 1932.
Sur l'échelle de l'électronegativités de Pauling, le fluorure est le premier, avec une valeur approximative de 3.98 ≈ 4.0.
Peut vous servir: hydrocarbures aliphatiques: propriétés, nomenclature, réactions, typesL'électronégativité est une propriété périodique des éléments. Dans la plupart des cas (il y a quelques exceptions), il est observé que l'électronégativité augmente lors du passage de gauche à droite dans les rangs du tableau périodique.
Et aussi, augmentez par le bas en haut, en se déplaçant sur une colonne.
 Le tableau périodique des électronégativités selon l'échelle Pauling. Le fluor est l'élément le plus électronégatif, situé au-dessus et à droite, tandis que Francio est le moins électronégatif de tous, ou le plus électropositif, s'il est préféré, et se trouve dans la colonne gauche et bas. Source: F. Zapata.
Le tableau périodique des électronégativités selon l'échelle Pauling. Le fluor est l'élément le plus électronégatif, situé au-dessus et à droite, tandis que Francio est le moins électronégatif de tous, ou le plus électropositif, s'il est préféré, et se trouve dans la colonne gauche et bas. Source: F. Zapata. Électronégativité fluor
La raison pour laquelle le fluor est l'élément le plus électronégatif du tableau périodique est dû à sa configuration électronique (la façon dont ses électrons sont disposés en orbitales autour du noyau).
Cette configuration est 122s22 P5, Le fluorure a donc 5 électrons dans sa couche la plus à l'extérieur.
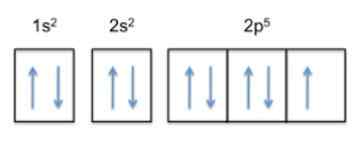
Maintenant, puisque la tendance de l'atome est de terminer sa couche externe, cela signifie que le fluor acceptera un électron d'autres atomes avec une grande facilité, afin de gagner la stabilité et de ressembler au noble gaz de la même rangée, qui est le néon , dont la configuration électronique est 122s22 P6.
L'atome de fluor a un très petit rayon, car les protons de leur noyau attirent très fortement les électrons, les gardant plus près que dans les atomes d'éléments moins électronégatifs, tels que le catesse et le francier.
Par conséquent, ces derniers sont prêts à abandonner facilement les électrons pour former des liens.
Les références
- Aguilar, C. Guide de l'unité d'apprentissage chimique I. Récupéré de: IPN.mx.
- Atkins, P. (2005). Principes de chimie, les chemins de découverte. 3e. Édition. Pan -American Medical Editorial.
- Clark, J. Électronégivité. Récupéré de: Chem.Bibliothèque.org.
- Hein, m. (2014). Fondations de la chimie du collège. 14e ed. Wiley.
- Lentech. Éléments chimiques commandés par son électronégativité. Récupéré de: lentech.est.

