Lien métallique
- 727
- 119
- Anaïs Julien
 Lien métallique en cuivre
Lien métallique en cuivre Quel est le lien métallique?
Il Lien métallique C'est celui qui maintient les atomes des éléments métalliques fortement unis. Il est présent dans les métaux et définit toutes leurs propriétés physiques qui les caractérisent comme durs, ductile, malléable et de bons conducteurs de chaleur et d'électricité.
De toutes les liaisons chimiques, la liaison métallique est la seule où les électrons ne sont pas localisés exclusivement entre une paire d'atomes, mais sont démocalisés entre des millions d'entre eux dans une sorte de colle ou de «mer d'électrons» qui les maintient fortement unis ou cohésif.
Par exemple, supposons le cuivre en cuivre. En cuivre, vos atomes cuisent vos électrons de valence pour former la liaison métallique. Ce lien est représenté comme cations cu2+ (cercles bleus) entourés d'électrons (cercles jaunes). Les électrons ne sont pas encore: ils se déplacent dans le verre en cuivre. Cependant, les métaux ne parlaient pas officiellement des cations, mais des atomes de métaux neutres.
Le lien métallique est vérifié en examinant les propriétés des éléments métalliques, ainsi que ceux de leurs alliages. Ceux-ci intègrent une série de matériaux brillants, argentés, tenaces et durs, qui ont également des points de fusion et d'ébullition élevés.
Comment est le lien métallique?
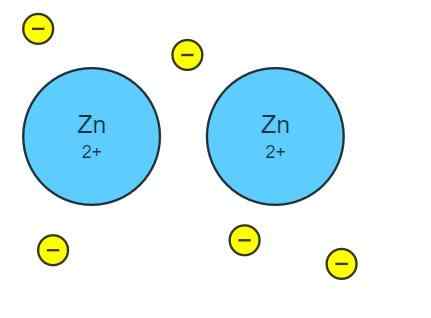
 Lien métallique en zinc
Lien métallique en zinc Le lien métallique n'est formé que entre un ensemble ou un groupe d'atomes métalliques. Pour que les électrons déménagent tout le verre métallique, il doit y avoir une «autoroute» à travers laquelle ils peuvent voyager. Ceci est conçu à partir du chevauchement de toutes les orbitales atomiques des atomes voisins.
Par exemple, considérez une rangée d'atomes de zinc, Zn ··· Zn ··· Zn ···. Ces atomes chevauchent leurs orbitales atomiques de Valencia pour créer des orbitales moléculaires. À son tour, ces orbitales moléculaires chevauchent d'autres orbitales d'atomes Zn voisins.
Chaque atome de zinc contribue deux électrons à contribuer à la liaison métallique. De cette façon, le chevauchement ou l'union des orbitales moléculaires, et les atomes donnés par le zinc, proviennent d'une «autoroute» par laquelle les électrons sont déplacés dans tout le verre comme s'ils étaient une colle ou une mer d'électrons, couvrant ou baigner tous les atomes métalliques.
Peut vous servir: réaction endergoniquePropriétés du lien métallique
Structure
Le lien métallique provient des structures compactes, où les atomes sont étroitement unis, sans beaucoup de distance qui les sépare. Selon le type de structure spécifique, il existe différents cristaux, certains les plus denses que d'autres.
Dans les structures métalliques, on ne parle pas correctement des molécules, mais des atomes neutres (ou des cations, selon d'autres perspectives). Revenant à l'exemple de cuivre, dans ses cristaux compactés, il n'y a pas de molécules Cu2, Avec un lien covalent Cu-Cu.
Réorganisation
Le lien métallique a la propriété de la réorganisation. Cela ne se produit pas avec les liens covalents et ioniques. Si un lien covalent est divisé, il ne sera plus formé comme si de rien ne s'était passé. De plus, les charges électriques dans la liaison ionique sont invariables à moins qu'une réaction chimique ait lieu.
Considérez par exemple le Metal Mercury pour expliquer ce point.
Le lien métallique entre deux atomes adjacents de mercure, Hg ··· Hg, peut être brisé et re-former avec un autre atome voisin si le verre est soumis à une force externe qui déforme le déformé.
Ainsi, le lien est réorganisé pendant que le verre souffre de la déformation. Cela donne aux métaux les propriétés d'être ductile et des matériaux malléables. Sinon, ils se briseraient comme des morceaux de verre ou de céramique, même chauds.
Conductivités thermiques et électriques
La propriété du lien métallique pour avoir ses électrons déplacés donne également aux métaux la possibilité d'effectuer la chaleur et l'électricité. Cela est dû au fait que, étant les électrons relocalisés et se déplaçant partout, les vibrations atomiques transmettent efficacement comme s'il s'agissait d'une vague. Ces vibrations sont traduites en chaleur.
D'un autre côté, lors du déplacement, les électrons sont des espaces vides derrière que d'autres peuvent occuper, ayant ainsi une vacance électronique par laquelle davantage d'électrons peuvent "courir" et ainsi provenir d'un courant électrique.
Peut vous servir: éthanamide: structure, propriétés, utilisations, effetsEn principe, sans aborder les théories physiques derrière le phénomène, c'est l'explication générale de la conductivité électrique des métaux.
Lustre métallique
Les électrons additionnés et mobiles peuvent également interagir avec des photons légers visibles et les rejeter. Selon les densités et la surface métallique, vous pouvez présenter différentes nuances gris ou argentées, ou même des flashs irisés. Les cas les plus exceptionnels sont ceux du cuivre, du mercure et de l'or, qui absorbent les photons de certaines fréquences.
Dregnocation d'électrons
Pour comprendre le lien métallique, il est nécessaire de comprendre ce qui est compris par la relocalisation des électrons. Il est impossible de déterminer où sont les électrons. Cependant, il peut être estimé dans quelle région de l'espace il est susceptible de les trouver. Dans une liaison covalente A-B, la paire d'électrons est distribuée dans l'espace qui sépare les atomes A et B; On dit alors qu'ils sont situés entre A et B.
Dans un lien métallique ab, cependant, on ne peut pas dire que les électrons se comportent de la même manière que dans une liaison covalente a-b. Ils ne sont pas situés entre deux atomes spécifiques de A et B, mais sont flous ou dirigés vers d'autres parties du solide où il y a aussi des atomes compactés, c'est-à-dire étroitement unis, de A et B.
Quand il en est ainsi, il est dit que les électrons de la liaison métallique sont déplacés: ils parcourent n'importe quelle direction où il y a des atomes de A et B, comme le montre la première image avec les atomes de cuivre et leurs électrons.
Par conséquent, dans la liaison métallique, on parle d'une relocalisation de ces électrons, et cette caractéristique est responsable de nombreuses propriétés que les métaux ont. Il soutient également la théorie de la mer des électrons.
Exemples de liens métalliques
Certains liens métalliques pour une utilisation courante dans la vie quotidienne sont les suivants:
- Éléments métalliques
Zinc
 Lien métallique en zinc
Lien métallique en zinc Dans le zinc, un métal de transition, ses atomes sont unis par le lien métallique.
Il peut vous servir: nitrate de magnésium (Mg (NO3) 2): structure, propriétés, utilisationsOr (AU)
L'or pur, comme les alliages de ce matériau avec du cuivre et de l'argent, sont actuellement extrêmement utilisés dans les bijoux fins.
Cuivre (Cu)
Ce métal est largement utilisé dans les applications électriques, grâce à ses excellentes propriétés de conduite en électricité.
Silver (AG)
Compte tenu de ses propriétés, ce métal est largement utilisé dans les deux applications de bijoux et dans le domaine industriel.
Nickel (ni)
Dans son état le plus pur, il est généralement utilisé pour la fabrication de pièces de monnaie, de batteries, de moulage ou de diverses pièces métalliques.
Cadmium (CD)
C'est un matériau très toxique et est utilisé dans l'élaboration des batteries.
Platine (PT)
Il est utilisé dans les bijoux fins (alliages avec de l'or) et dans l'élaboration des instruments de mesure de laboratoire et des implants dentaires.
Titane (Ti)
Ce métal est couramment utilisé dans la branche d'ingénierie, ainsi que dans la fabrication d'implants ostéosynthétiques, d'applications industrielles et de bijoux.
Plomb (PB)
Ce matériau est utilisé dans l'élaboration des conducteurs électriques, plus précisément, pour la fabrication de la couverture extérieure des câbles téléphoniques et télécommunications.
- Composés métalliques
Acier commun
La réaction en fer avec le carbone produit de l'acier commun, un matériau beaucoup plus résistant aux efforts mécaniques par rapport au fer.
Acier inoxidable
Il est possible de trouver une variation du matériau précédent en combinant l'acier commun avec des métaux de transition tels que le chrome et le nickel.
Bronze
Il se produit lors de la combinaison du cuivre avec l'étain, dans une proportion approximative de 88% et 12%, respectivement. Il est utilisé dans l'élaboration des devises publiques, des outils et des ornements.
Alliages de mercure
Divers alliages de mercure avec d'autres métaux de transition, tels que l'argent, le cuivre et le zinc, produisent les amalgames utilisés en dentisterie.
Alliage chromé et platine
Ce type d'alliage est largement utilisé pour faire des feuilles de rasage.
Cuir
Cet alliage d'étain, l'antimoine, le bismuth est couramment utilisé pour l'élaboration des ustensiles ménagers.
Laiton
Il est généré en combinant le cuivre avec le zinc, dans une proportion de 67% et 33%, respectivement. Il est utilisé dans la fabrication d'articles matériels.

