Triple liaison covalente
- 1472
- 28
- Justine Charpentier
Nous expliquons ce qu'est un triple lien, ses caractéristiques et donnons plusieurs exemples
 Molécule d'acétylène (C2H2) avec sa triple liaison entre les deux atomes de carbone
Molécule d'acétylène (C2H2) avec sa triple liaison entre les deux atomes de carbone Qu'est-ce qu'un triple lien covalent?
Les triples obligations covalentes Ce sont des liens chimiques dans lesquels deux atomes partagent trois paires d'électrons. En d'autres termes, ce sont des liaisons covalentes formées par un total de six électrons de valence qui tournent autour de deux atomes.
Il existe de nombreux composés chimiques qui contiennent des triples liens. Par exemple, les composés organiques tels que les alcynes contiennent des liaisons covalentes triple C-C. Les nitriles sont également caractérisés par un groupe qui contient un carbone lié à l'azote au moyen d'une liaison covalente triple C-N. D'autres composés inorganiques tels que l'azote moléculaire dans l'air contiennent également des liaisons covalentes triples.
Avoir 6 électrons qui tournent autour de deux noyaux donnent des liens triples de nombreuses caractéristiques particulières. La forme des molécules qui les contiennent, et les réactions chimiques dans lesquelles ils peuvent participer sont différentes de celles des liaisons doubles ou simples.
Caractéristiques de liaison covalente triple
Ils sont formés par 6 électrons
Ces liaisons sont formées par 6 électrons et se forment lorsque chacun des deux atomes impliqués partage trois de ses électrons disparus avec l'autre. C'est la raison pour laquelle ils sont appelés triples liens, car ils ont triple le nombre d'électrons de la simple liaison covalente.
Ils ont une liaison sigma (σ) et deux liaisons Pi (π)
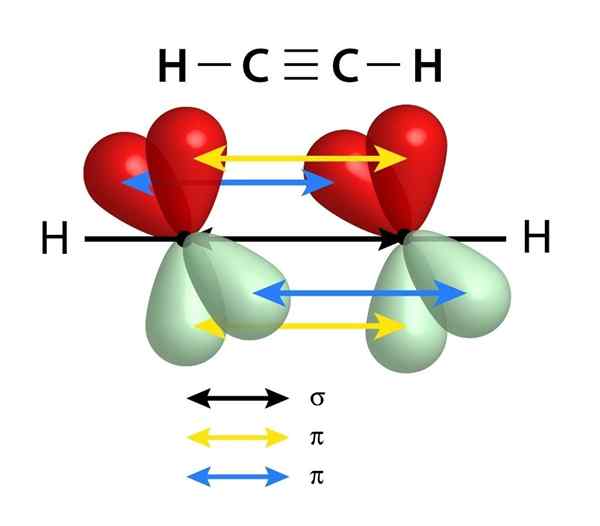 Schéma des liens qui constituent un triple lien entre deux atomes de carbone. La flèche noire du centre représente la liaison sigma, tandis que le jaune et le bleu représentent chacune des deux liaisons Pi
Schéma des liens qui constituent un triple lien entre deux atomes de carbone. La flèche noire du centre représente la liaison sigma, tandis que le jaune et le bleu représentent chacune des deux liaisons Pi Semblable aux doubles liaisons, les triples liens sont également formés par un lien sigma qui passe par le centre de la ligne qui rejoint les deux atomes liés. Cependant, contrairement aux doubles liens qui en ont un, les triples liens ont deux liens PI en plus du lien Sigma.
Peut vous servir: chlorure de cuivre (i) (CUCL): structure, propriétés, utilisationsIls forment presque toujours des composés linéaires
Lorsque deux atomes de carbone forment un triple lien, chacun a encore la possibilité de former un lien simple supplémentaire avec un autre atome (car le carbone peut former 4 liaisons au total).
Dans ces cas, les deux carbones et les deux autres atomes qui y sont attachés formeront une ligne droite. Cette forme que la molécule acquiert est appelée géométrie linéaire.
Ce sont les liaisons covalentes les plus fortes
Lorsque vous comparez les triples liens entre deux atomes avec les liaisons doubles et simples entre ces mêmes atomes, il est observé que les triples liaisons sont toujours plus forts que les autres types de liaison covalente. Cela signifie qu'il est plus difficile de rompre un triple lien qu'un double ou un simple.
En effet, en plus, avoir à rompre la liaison Sigma (qui est également présente dans les liaisons simples et doubles), pas une ne doit pas se casser (comme dans les doubles liaisons) mais deux liaisons PI supplémentaires.
Ils sont plus courts que les doubles liaisons ou aussi simples
En raison du même fait d'être des liens plus forts, les triples liens gèrent.
Ils représentent deux insaturation
Chaque carbone qui a une triple liaison n'aura qu'un lien supplémentaire avec un autre atome. Cela signifie qu'un tel carbone ne serait lié qu'à deux atomes, au lieu de quatre, il a donc moins d'hydrogène qu'il ne pourrait en posséder s'il ne formait que des liaisons simples.
Peut vous servir: heptano (C7H16): structure, propriétés et utilisationsC'est ce qu'on appelle l'insaturation et les composés avec des liaisons triples ont deux insaturation, car chacun des deux carbones conviendrait à 2 hydrogènes supplémentaires, sinon pour le triple lien.
Ce sont des liens rigides
Comme les doubles liaisons, les triples liens sont rigides et difficiles à plier ou à tord. Cela est dû à la fois à la plus grande force de liaison et à la longueur la plus basse.
Ils peuvent agir comme des bases
Certains composés avec des liens triples peuvent utiliser les électrons Pi dudit lien vers le lien ou accepter les ions+, Par conséquent, agissant comme bases.
Ils peuvent les hydrogène pour donner des liens doubles ou simples
L'insaturation du triple lien peut être retirée en cassant les liaisons PI et en ajoutant des hydrogènes aux deux carbones. C'est ce qu'on appelle l'hydrogénation. Si seule une molécule d'hydrogène à une triple liaison est ajoutée, elle deviendra une double liaison. Si deux molécules d'hydrogène sont ajoutées, elle deviendra une simple liaison.
Exemples de liaisons covalentes triples
Molécule d'azote (n2)
La molécule d'azote contient une triple liaison covalente entre les deux atomes d'azote. Chaque atome partage ses trois électrons de valence disparus avec l'autre, et chaque nouvel couple d'électrons devient la liaison Sigma ou l'une des deux liaisons Pi que la molécule possède.
 Molécule d'azote
Molécule d'azote Dans ce cas, les deux atomes d'azote et les électrons indemnes se marient que chacun d'eux est situé le long d'une ligne droite.
Le bon (une alcyne de formule C3H4)
Le propre est le deuxième alcyne le plus simple qui existe. Ce composé est composé d'une chaîne à trois carbone, dont deux sont liées par un triple lien covalent.
Peut vous servir: hydrocarbures insaturés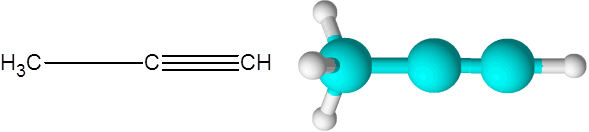 Molécule de propin
Molécule de propin Ici, vous pouvez également voir que les trois carbones et le dernier atome d'hydrogène (celui à droite) forme une ligne droite. Dans le modèle, on peut également voir que le lien C-C simple est plus long que le lien Triple C-C.
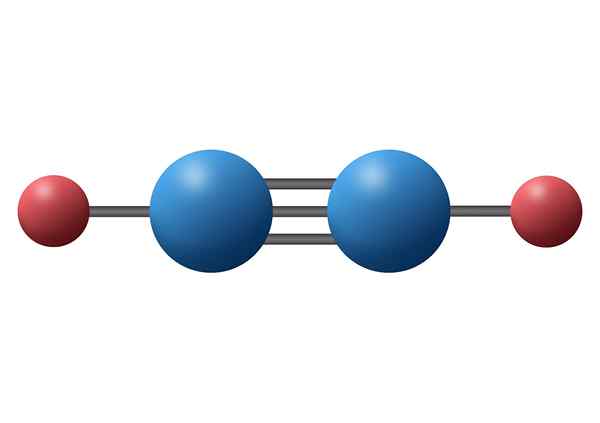
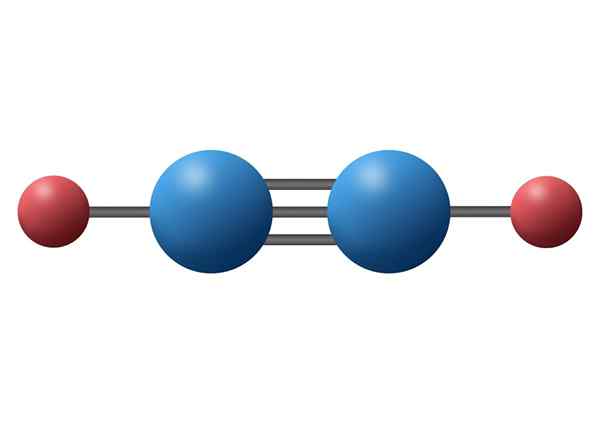
Monoxyde de carbone (CO)
Le monoxyde de carbone est un gaz inorganique toxique qui a un atome de carbone négatif et un oxygène positif lié au moyen d'une triple liaison covalente. Dans ce cas, il s'agit d'une liaison polaire, en raison de la différence d'électronégativités entre le carbone et l'oxygène.
 Molécule de monoxyde de carbone
Molécule de monoxyde de carbone

