Liaison double covalente

- 3060
- 951
- Mlle Ambre Dumont
Nous expliquons ce qu'est une liaison double covalente, ses caractéristiques et en donnant plusieurs exemples
 Eteno ou molécule d'éthylène. C'est un exemple typique d'une double liaison covalente entre deux atomes de carbone
Eteno ou molécule d'éthylène. C'est un exemple typique d'une double liaison covalente entre deux atomes de carbone Qu'est-ce qu'une double liaison covalente?
Les Double liaisons covalentes Ce sont des liens chimiques dans lesquels deux atomes partagent deux paires d'électrons. En d'autres termes, ce sont des liaisons covalentes formées par un total de quatre électrons de valence qui tournent autour de deux atomes.
Les doubles liens sont très courants dans les composés organiques. Par exemple, tous les alcènes ont une double liaison carbone-carbone. De nombreux autres groupes fonctionnels tels que les aldéhydes, les cétones, les acides carboxyliques et les amides ont également des liaisons doubles covalentes entre le carbone et l'oxygène. D'autres, comme imine ont des liaisons doubles covalentes c = n.
Les doubles liens ont de nombreuses caractéristiques qui les distinguent des autres types de liaisons covalentes telles que des liens simples et des triples liens. Ils diffèrent dans la forme des molécules qui les contiennent, par la longueur et la force de liaison et d'autres caractéristiques liées à leurs propriétés chimiques.
Caractéristiques de liaison double covalente
Ils sont formés par 4 électrons
La raison pour laquelle les doubles liaisons sont parce qu'elles contiennent des électrons doubles d'une simple liaison covalente, qui se forme lorsque deux atomes partagent deux électrons de valence. Cela signifie que chaque double liaison contient 4 électrons.
Ils sont formés par une liaison sigma (σ) et un lien pi (π)
Sur les 4 électrons qui forment une double liaison, 2 d'entre eux vont et viennent entre un atome et un autre, passant par le centre des deux. Cette paire d'électrons est appelée électrons Sigma, car ils forment une liaison Sigma (σ).
L'autre paire d'électrons flotte au-dessus et en dessous des deux atomes faisant une sorte de sandwich. Ces électrons sont appelés électrons Pi et forment un lien pi (π).
Peut vous servir: chlorobenzène (C6H5CL)Ensemble, la liaison Sigma et la liaison PI forment la liaison double covalente.
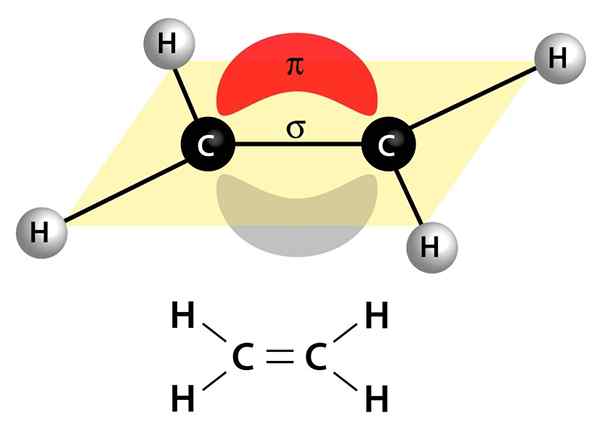 Cette image montre les deux liens qui constituent une double liaison: le lien Pi qui apparaît comme un nuage rouge et gris qui est au-dessus et sous la molécule, et le lien sigma qui est la ligne qui rejoint les deux noyaux à travers le centre
Cette image montre les deux liens qui constituent une double liaison: le lien Pi qui apparaît comme un nuage rouge et gris qui est au-dessus et sous la molécule, et le lien sigma qui est la ligne qui rejoint les deux noyaux à travers le centre Ils peuvent être polaires ou apolaires
Selon l'électronégativité des atomes unis au moyen d'une double liaison covalente, elle peut être polaire ou apolaire.
Par exemple, une double liaison covalente C = C Ce sera un lien apolar, car les deux atomes sont les mêmes et ont la même électronégativité. Au lieu de cela, une double liaison covalente C = O Ce sera polaire, car l'oxygène est beaucoup plus électronégatif que le carbone.
Ils sont plus forts que les liens simples
Briser une double liaison est plus difficile que de rompre un simple lien entre les deux mêmes atomes. En effet, pour briser une double liaison, une liaison Sigma (qui est égale au lien simple) et une liaison PI doivent être rompues. Comme deux liens doivent être cassés au lieu d'un, la double liaison est plus forte que la simple.
Ils sont plus faibles que les triples liens
Comparé au triple lien, la double liaison est plus faible et plus facile à casser. La raison en est la même qu'auparavant, seulement que, dans ce cas, la double liaison a moins de liens que la rupture par rapport au triple lien.
Ils sont plus courts que les liens simples
Étant des liens plus forts que les liens simples, les doubles liaisons sont capables de rapprocher les atomes liés que les liens simples que les liens simples. Pour cette raison, si un lien double C = C est comparé à un lien C-C simple, le premier est toujours plus court que le second.
Peut vous servir: thiosulfate de sodium (NA2S2O3)Ils sont plus longs que les triples liens
Encore une fois, lorsque le triple lien est plus fort que le double lien, le triple lien est plus court. Cela implique que les liaisons doubles covalentes sont plus longues que le triple.
Ce sont des liens rigides.
Les liaisons covalentes simples sont assez flexibles et peuvent également tourner. D'un autre côté, les doubles liaisons sont rigides, elles ne sont pas flexibles et ne peuvent pas être tournées, car la liaison Pi mentionnée ci-dessus serait brisée.
Ils représentent l'insaturation
Une molécule qui a une double liaison aura deux atomes d'hydrogène moins liés qu'il ne pourrait avoir. Pour cette raison, il est dit qu'une double liaison représente une insaturation (chaque insaturation correspond à 2 hydrogènes).
Ils forment des molécules à forme de triangle plate
Un atome de carbone qui forme une double liaison covalente et deux autres liaisons simples, forme toujours une molécule plate dans laquelle les trois liaisons pointent vers les extrémités d'un triangle. Cette forme est appelée géométrie trigonale plate.
Exemples de liaisons doubles covalentes
Lien c = c en éthylène
L'éthylène est l'un des exemples les plus simples d'une liaison double covalente, dans ce cas entre deux atomes de carbone.
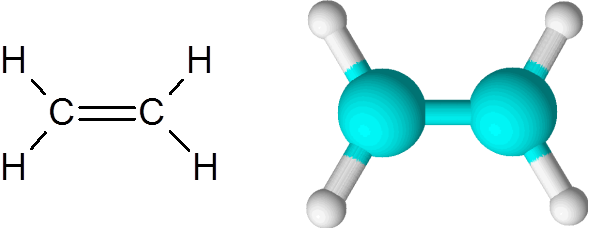 Molécule d'éthylène
Molécule d'éthylène La molécule est complètement plate et il n'est pas possible de faire pivoter le lien dans n'importe quelle direction. Cette double liaison est totalement apolaire, car elle relie deux atomes égaux.
Lien c = o en acétone
Toutes les cétones contiennent un groupe carbonyle, qui se compose d'un atome de carbone et d'un atome d'oxygène unis au moyen d'une double liaison covalente.
Peut vous servir: qu'est-ce que la cinétique chimique?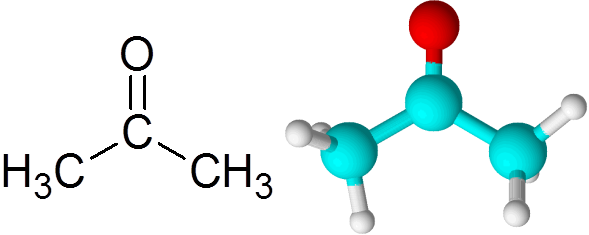 Molécule d'acétone
Molécule d'acétone Chaque atome contribue deux électrons manquants pour former à la fois le lien PI et Sigma qui constitue la double liaison. La plupart des réactions chimiques qui se produisent aux cétones sont dues à la double liaison c = o.
Le lien o = ou dans la molécule d'ozone (ou3)
Dans ce cas, l'atome d'oxygène central est lié à deux autres atomes d'oxygène. L'une des deux liaisons est formée par 4 électrons, donc il correspond à une liaison double covalente. Les trois atomes et quelques électrons sans partage qui ont l'atome d'oxygène central sont tous dans le même plan de l'écran pointant vers les coins d'un triangle.
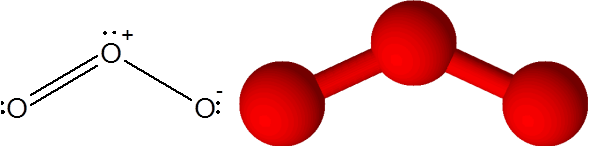 Molécule d'ozone
Molécule d'ozone L'ozone a la particularité que la double liaison peut "sauter" de l'un des oxygène terminal à l'autre. En fait, il le fait très rapidement à travers un processus appelé Resonance.
C = c liens dans le butadien (c4H6)
Butadieno est un exemple de composé organique qui a deux liaisons doubles covalentes c = c.
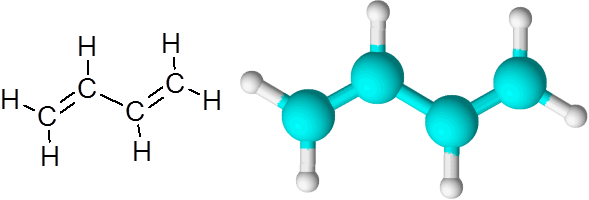 Molecule 1.3-butadiène
Molecule 1.3-butadiène Lorsque les doubles liaisons sont de cette manière, séparées par un seul lien simple, il est dit qu'ils sont des doubles liens conjugués.

