Énergie interne

- 631
- 5
- Paul Dumas
Nous expliquons ce qu'est l'énergie interne, sa fonction, comment la calculer et donner plusieurs exemples
 Diagramme montrant des contributions à l'énergie interne d'un système. Source: F. Zapata
Diagramme montrant des contributions à l'énergie interne d'un système. Source: F. Zapata Qu'est-ce que l'énergie interne?
La énergie interne D'un objet provient du mouvement aléatoire que les atomes et les molécules qui le composent ont. Même lorsque l'objet est parfaitement au repos, à l'intérieur, au niveau microscopique, les particules qui la composent se déplacent en continu sans repos.
Étant donné que ces particules se déplacent, elles ont une énergie cinétique, qui fait partie de leur énergie interne. L'autre contribution à l'énergie interne est l'énergie potentielle qui provient des forces intermoléculaires, responsable du maintien de la cohésion de la substance.
Ces forces intermoléculaires sont généralement d'origine électromagnétique, mais les forces gravitationnelles et nucléaires participent également.
Maintenant, selon le type de mouvement des particules, l'énergie cinétique peut être:
- Translation
- Vibratoire
- Rotation
La température ne mesure que l'énergie cinétique translationnelle des particules. En principe, à plus grande température, l'énergie interne sera plus grande, mais cela dépend également de la masse. UN exemple Le problème clarifie: un verre à l'eau tiède a moins d'énergie interne qu'un lac à température ambiante, bien que la température du verre soit plus élevée, et c'est parce qu'il y a plus d'eau dans le lac que dans le verre.
Dans tous les cas, l'énergie interne d'une substance n'est pas visible en vue, elle ne dépend pas de son mouvement, ni de sa position relative par rapport à d'autres objets. Par exemple, l'énergie interne d'un verre avec de l'eau à température ambiante est la même si le verre est sur une table ou s'il est sur le sol.
Peut vous servir: vecteurs non copplanaires: définition, conditions, exercicesFonction d'énergie interne
L'énergie interne, qui est généralement indiquée comme U, est une fonction qui dépend des variables thermodynamiques du système, telles que la température T et le volume V. Par conséquent, il peut s'exprimer mathématiquement comme:
U = u (t, v)
En réalité, la valeur absolue de l'énergie interne d'un système n'est pas pertinente, ce qui compte, c'est sa variation, qui est indiquée avec la lettre grecque Δ («Delta»):
Δu = u initial - OU final
Maintenant, l'énergie interne peut varier si la chaleur est ajoutée ou extraite. Ajout de chaleur Il est possible que le système fasse un certain travail, comme un piston dans le cylindre d'un moteur.
La première loi de la thermodynamique
D'après la première loi de la thermodynamique, il est établi que La variation de l'énergie interne À partir d'un système équivalent à:
Δu = q - w
Où est la quantité de chaleur qui est transférée au système et w est le travail que fait le système, au cas où il effectue certains. Tout est mesuré en joules dans le système international d'unités.
Si le système ne fonctionne pas, la chaleur fournie est utilisée dans son intégralité pour augmenter l'énergie interne du système.
Ce qui suit découle de l'expression précédente:
- Δu> 0 signifie que le système augmente son énergie interne
- ΔU < 0 la energía interna del sistema disminuye
- Q> 0 Le système absorbe la chaleur
- W> 0 Le système fonctionne.
Comment calculer l'énergie interne?
Le gaz idéal monoatomique
Dans le modèle de gaz idéal monoatomique (un seul atome), les particules n'interagissent pas entre elles, de sorte que l'énergie cinétique translationnelle est la seule contribution à l'énergie interne ou au gaz. Il y a un théorème, appelé Théorème d'équipement, qui indique que chaque degré de liberté a une énergie égale à:
Il peut vous servir: diffraction des vagues: concept et exemplesOù t est la température et R est la constante des gaz idéaux, dont la valeur des unités du système international est:
8.314472 J / mol ∙ K
Un degré de liberté représente la possibilité de se déplacer dans une certaine direction dans l'espace. Une particule de gaz idéale peut se déplacer dans les trois directions de l'espace, par conséquent, l'énergie de n moles de gaz est:
Quantité de chaleur
En supposant que la chaleur est ajoutée à un système et cela ne fonctionne pas, cette chaleur n'est utilisée que pour augmenter l'énergie interne du système. La quantité de chaleur qui doit être proportionnelle à la masse m du système et le changement de température:
Q ∝ m⋅Δt
La constante de proportionnalité dépend de la substance et est appelée chaleur spécifique. Appelant C à cette constante, la chaleur est:
Q = mc⋅Δt
Comme la chaleur est inversée dans l'augmentation de l'énergie interne:
Q = mc⋅Δt = Δu
ΔU correspond à la variation En énergie interne.
Exemples d'énergie interne
1. Variations de température
Les changements dans la température des substances génèrent à leur tour des changements dans leur énergie interne. C'est ce qui se passe, par exemple, lors de la cuisson. En chauffant les aliments, l'agitation de ses molécules augmente, l'énergie cinétique augmente et fait donc son énergie interne.
2. Énergie interne de deux substances à la même température
Deux substances à la même température n'ont pas nécessairement la même énergie interne, car elle dépend de deux contributions: l'énergie cinétique et l'énergie potentielle.
Si les substances sont à la même température, on peut affirmer que l'énergie cinétique translationnelle de ses particules est la même, mais l'énergie potentielle est différente, car cela dépend de la configuration des atomes constitutifs.
Peut vous servir: pression hydrostatique: formule, calcul, exemples, exercices3. Dilatation thermique
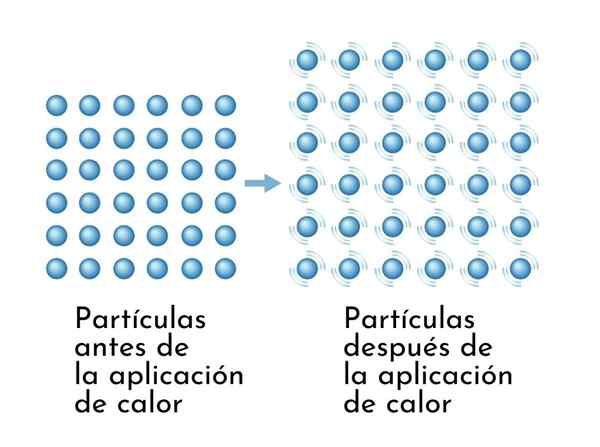 Les substances se développent lorsqu'elles sont chauffées, car l'augmentation de l'énergie interne fait vibrer leurs particules, donc les dimensions augmentent
Les substances se développent lorsqu'elles sont chauffées, car l'augmentation de l'énergie interne fait vibrer leurs particules, donc les dimensions augmentent Une conséquence visible des substances chauffantes est l'augmentation de leurs dimensions, car la distance moyenne entre ses atomes augmente.
Les forces intermoléculaires peuvent être simulées à travers des ressorts qui unissent l'atome.
4. Gaz comprimés
Les gaz comprimés peuvent stocker l'énergie interne, car leur densité augmente en diminuant le volume et avec elle ses interactions avec les murs du conteneur de conteneur. De cette façon, un gaz comprimé est capable de faire un travail comme déplacer un piston.
5. Batteries
Dans une batterie, les réactions chimiques se produisent capables de générer un courant électrique dès que le circuit se ferme. Cette énergie potentielle chimique est considérée comme faisant partie de l'énergie interne du système.
6. Système qui absorbe la chaleur et fonctionne
Lorsqu'un système absorbe la chaleur, il augmente son énergie interne. Mais si en même temps il fait un travail, la première loi de la thermodynamique peut être utilisée pour savoir combien d'énergie interne change. Par exemple, en supposant qu'un système absorbe 175 J de chaleur et effectue un travail équivalent à 62 J, le changement de son énergie interne est:
ΔU = Q - W = 175 J - 62 J = 113 J.



