Énergie d'activation

- 1908
- 261
- Lucas Schneider
Nous expliquons quelle est l'énergie d'activation, sa formule, les unités, comment elle est calculée et nous donnons plusieurs exemples
Qu'est-ce que l'énergie d'activation?
La énergie d'activation (ETpour) Il est défini comme l'énergie minimale nécessaire pour qu'une réaction chimique soit effectuée. En d'autres termes, c'est la barrière d'énergie qui doit être surmontée afin que les réactifs puissent devenir des produits.
L'énergie d'activation peut être vue en action dans la vie quotidienne. En effet, nous savons tous que, lors de l'ouverture de la clé de passage de gaz dans la cuisine, elle ne brûle pas immédiatement lorsqu'elle entre en contact avec l'air.
Pour que la réaction de combustion commence, il est nécessaire de fournir une étincelle ou le feu d'un match sur. Cette étincelle ou ce feu représente l'énergie d'activation de la réaction de combustion.
Pourquoi une énergie d'activation est-elle requise?
Pour comprendre la raison pour laquelle les réactions ont besoin d'une énergie minimale pour se produire, il est important de comprendre, en premier lieu, comment ils se produisent. Pour que deux atomes ou molécules réagissent, ils doivent d'abord entrer en collision. De plus, ils doivent le faire avec la bonne orientation afin que de nouvelles liaisons chimiques puissent être formées et que les personnes âgées peuvent se casser.
Cependant, même si les deux molécules sont dirigées les unes contre les autres avec l'orientation parfaite, cela ne garantit pas qu'une collision efficace est donnée, en raison de la répulsion entre les électrons de la surface des molécules.
Pour cette raison, il est nécessaire que, en plus d'une orientation correcte, les molécules se déplacent également avec une certaine vitesse ou avec une certaine énergie cinétique minimale qui garantit que la collision est suffisamment forte pour contrer la répulsion des électrons.
Cette énergie cinétique minimale nécessaire au niveau microscopique est celle qui se traduit par l'énergie d'activation de la réaction.
Peut vous servir: Bromide au lithium: structure, propriétés, utilisations, risquesCe qui est vu dans un diagramme d'énergie?
Un diagramme d'énergie est une représentation graphique qui montre comment l'énergie des réactifs varie lorsqu'ils sont transformés en produits. Dans ces diagrammes, comme celui présenté ci-dessous, il est facile de voir et d'interpréter l'énergie d'activation.

Dans ce graphique, la ligne bleue montre l'énergie à mesure que la réaction progresse. Ici, vous pouvez voir que, pour devenir les produits, les réactifs doivent d'abord surmonter une colline pour atteindre l'état de transition. Sinon, ils seront retournés à leur état initial.
La hauteur de cette colline est une énergie d'activation précisément. S'il est possible de surmonter, le reste de la route est en descente et les réactifs finissent rapidement de devenir les produits.
Unités d'énergie d'activation
L'énergie d'activation est une ampleur intensive qui est exprimée en unités d'énergie sur la masse ou les taupes. Comme il existe différentes unités d'énergie et différentes unités de masse, l'énergie d'activation peut être exprimée dans plusieurs unités différentes. Cependant, ceux utilisés le plus fréquemment en chimie sont:
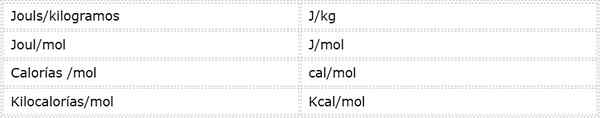
Quelle unité est utilisée dépend des données à partir desquelles il est calculé, ou de l'utilisation qui sera donnée dans d'autres calculs.
Formule d'énergie d'activation
L'énergie d'activation est liée à la vitesse de réaction. En fait, plus l'énergie d'activation est grande, plus la vitesse est faible. Cette relation s'exprime mathématiquement à travers l'équation d'Arrhenius, qui relie la vitesse constante d'une réaction à la température.
Peut vous servir: réactif Benedict: à quoi sert-il, composants, préparation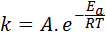
Dans cette équation, k C'est la vitesse constante de la réaction, etpour C'est l'énergie d'activation, R est la constante des gaz idéaux, t est la température absolue et est appelé facteur pré-exponentiel d'Arrhenius, également appelé facteur de collision.
Cette équation peut être réorganisée pour donner:
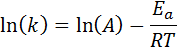
Si la valeur de A pour la réaction est connue, alors l'énergie d'activation peut être obtenue en effacistant l'équation précédente. Cependant, ce n'est pas la façon dont l'énergie d'activation d'une réaction est généralement déterminée. Normalement, la constante de vitesse est déterminée à deux ou plusieurs températures, ce qui rend inutile à savoir.
Comment l'énergie d'activation est-elle calculée?
L'énergie d'activation est déterminée à partir des valeurs de la constante de vitesse à différentes températures. Au moins deux valeurs de k mesuré à différentes valeurs t pour calculer l'énergie d'activation sans le savoir, ce qui est généralement le cas.
En fonction du nombre de valeurs de k Ils ont, vous pouvez calculer etpour De deux façons:
1. Lorsque vous avez k à deux températures
Dans ces cas, il est plus facile de commencer la première forme de l'équation d'Arrhenius. Si nous appelons k1 à la vitesse constante à la température T1 et k2 à la vitesse constante à la température T2, Ensuite, nous pouvons écrire deux fois l'équation d'Arrhenius:
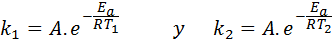
Maintenant, nous pouvons diviser l'une des deux équations entre les autres pour annuler A:
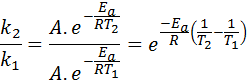
Ensuite, en prenant un logarithme népérienne des deux côtés et en résolvant pour Epour, Est obtenu:
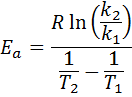
2. Lorsque vous avez k Plus de deux températures
Dans les cas où il y a plusieurs déterminations de la vitesse constante à différentes températures, il est préférable de trouver graphiquement l'énergie d'activation ou au moyen d'une régression linéaire. Ceci est basé sur l'équation sous forme logarithmique, qui a la forme d'une ligne:
Il peut vous servir: Clausius-Clapeyron Equation: à quoi sert, des exemples, des exercices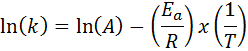
Si nous fabriquons un graphique de Ln (k) contre (1 / t), nous obtiendrons une ligne droite qui coupe à l'axe et en ln (a) et dont la pente est égale à - (epour/ R). À partir de là, l'énergie d'activation est obtenue.
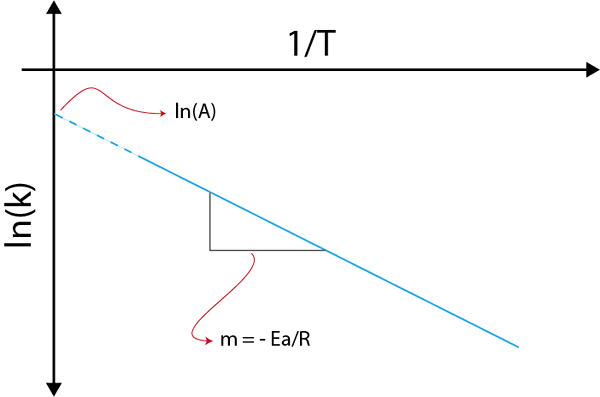 Graphique Arrhenius pour déterminer l'énergie d'activation
Graphique Arrhenius pour déterminer l'énergie d'activation Exemples de calcul des énergies d'activation
Exemple 1
La constante de vitesse d'une réaction de premier ordre a été déterminée à deux températures différentes. 298 K avait une valeur de 0.058 s-1, tandis qu'à 350 K, la valeur a augmenté à 0,425 s-1. Déterminez l'énergie d'activation de cette réaction dans J / Mol.
- Solution: Comme vous avez la constante à deux températures, la formule d'énergie d'activation illustrée ci-dessus peut être utilisée directement. Comme l'énergie est demandée en unités J / Mol, nous devons utiliser la constante de gaz dans ces unités:
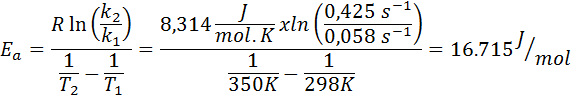
Exemple 2
La vitesse de vitesse pour une réaction chimique de deuxième ordre est mesurée à différentes températures. Les valeurs sont présentées dans le tableau suivant. Déterminez l'énergie d'activation en kcal / mol.
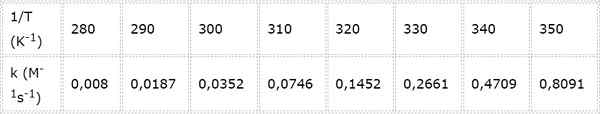
- Solution: Comme dans ce cas, il y a plusieurs températures, il est préférable de déterminer graphiquement l'énergie d'activation. Pour ce faire, un graphique de Ln (k) vs 1 / t est fabriqué, qui est présenté ci-dessous.
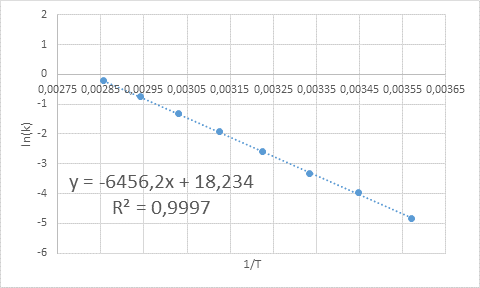 Exemple de détermination graphique de l'énergie d'activation
Exemple de détermination graphique de l'énergie d'activation À partir de l'équation de la ligne indiquée dans le graphique, la pente est obtenue, qui est -6456.2. Comme la pente (m) est égale à - epour/ R, alors:
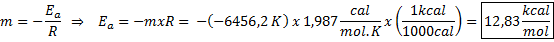
C'est-à-dire que l'énergie d'activation de cette réaction est de 12,83 kcal / mol.

