Électrons internes
- 2129
- 651
- Louna Baron
Nous expliquons ce que sont les électrons internes, leurs caractéristiques et donnons plusieurs exemples
Que sont les électrons internes?
Chaque fois que nous pensons à un atome, nous imaginons un noyau formé par des protons et des neutrons, entourés par les électrons qui tournent autour de lui, similaire à la façon dont les planètes tournent autour du soleil.
Mais tous les électrons ne sont pas identiques et deux classes peuvent être distinguées, selon leur proximité ou leur éloignement du noyau atomique.
Certains sont plus éloignés du noyau et sont appelés électrons de valence. Ceux-ci sont responsables de toutes les réactions chimiques que nous connaissons. D'un autre côté, Ceux qui sont les plus proches du noyau et qui y sont plus fortement unis, sont ceux que nous appelons les électrons internes.
Caractéristiques des électrons internes
Ce sont les électrons les plus stables
En règle générale, plus le niveau d'énergie d'un électron est bas. Les électrons internes occupent les orbitales aux niveaux d'énergie les plus bas d'un atome, par conséquent, ils sont également les électrons les plus stables.
Ils sont plus fortement unis au noyau
Le noyau attire les électrons car les deux ont des charges opposées: le noyau est positif tandis que les électrons négatifs. Cette force augmente à mesure que la distance diminue.
En conséquence, les électrons internes, qui sont ceux qui sont les plus proches du noyau, sont également ceux qui sont le plus fortement liés à la même. Pour cette même raison, ce sont également les électrons les plus difficiles à éliminer.
Ils ne font pas partie des liaisons chimiques
Quand un atome en approche un autre, la première chose à toucher est leurs électrons les plus à l'extérieur. Pour cette raison, seuls les électrons de Valencia interviennent dans les réactions chimiques. Les électrons internes ni participent à des liaisons chimiques, ni impliqués dans une réaction chimique.
Il peut vous servir: combien d'électrons de garde?Ils sont très blindants
Cela signifie que les électrons internes se tiennent entre les électrons externes et le noyau, créant une sorte d'écran qui réduit la force avec laquelle le noyau attire les électrons de la valence.
Ils viennent toujours par paires
Dans chaque orbitale, il n'y a que deux électrons avec des tours opposés, qui sont appelés électrons appariés (ce qui est une autre façon de dire qu'ils forment un couple). Comme les orbitales où se trouvent les électrons internes, ils sont toujours complètement pleins, donc ces électrons sont toujours appariés.
Comment savons-nous combien d'électrons internes un atome a-t-il?
Savoir combien d'électrons internes ont un atome est très simple. Vous avez juste besoin de savoir combien d'électrons a l'atome et combien de ces électrons appartiennent à la couche de valence. Tous les autres électrons sont des électrons internes.
Mais comment découvrir ces chiffres? Dans les sections suivantes, nous l'expliquons.
Le nombre total d'électrons est égal au nombre atomique
Comme les atomes sont neutres (c'est-à-dire qu'ils n'ont pas de charge électrique nette), ils doivent avoir le même nombre de charges positives (protons) que des charges négatives (électrons). Comme le nombre atomique indique le nombre de protons dans le noyau, il indique également combien d'électrons est un atome lorsqu'il est neutre.
Dans le cas des ions, qui contrairement aux atomes ont une charge électrique, le nombre total d'électrons est obtenu en soustrayant le nombre atomique sauf la charge ionique, avec tout et leur signe.
Exemples
- L'atome de carbone (c) est le numéro 6 de l'élément du tableau périodique (c'est-à-dire son numéro atomique). Par conséquent, l'atome de carbone a 6 électrons au total.
- L'ion sodium (i) (na+) a une charge positive de +1 et le nombre atomique de sodium est 11. Le nombre total d'électrons de cet ion est donc: 11 - (+1) = 10 électrons.
- L'ion chlorure (Cl-) a une charge négative de -1 et le nombre atomique de chlore est de 17. Le nombre total d'électrons de cet ion est donc: 17 - (- 1) = 17 + 1 = 18 électrons.
Le nombre d'électrons de Valence est égal à leur groupe dans le tableau périodique
Les éléments qui appartiennent au groupe 1A (les métaux alcalins) ont tous 1 électron de Valence. Ceux qui appartiennent au 2ème (Alcaliner) ont 2, ceux du 3ème (groupe Boro, aluminium, gallium, etc.) Ils ont 3 et ainsi de suite. Cela ne s'applique pas aux métaux de transition.
Comme avant, les ions sont soustraits de calculer leurs électrons de valence.
Exemples
- L'oxygène appartient au groupe 6A pour ce qui contient 6 électrons de valence.
- L'ion sulfure (s2-) Il appartient également au groupe 6A, mais a une charge de -2, donc il a: 6 - (- 2) = 6 + 2 = 8 électrons de valence.
Exemples d'atomes différents et de leurs électrons internes
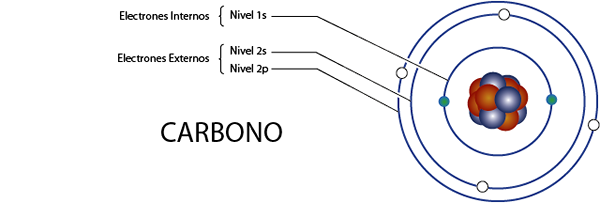
Electrons en carbone interne (C)

Comme nous l'avons vu il y a un instant, le carbone a 6 électrons au total. De plus, il appartient au groupe 4A pour ce qui a 4 électrons de Valence, donc il a, au total 6 - 4 = 2 électrons internes.
Électrons azotés internes (n)
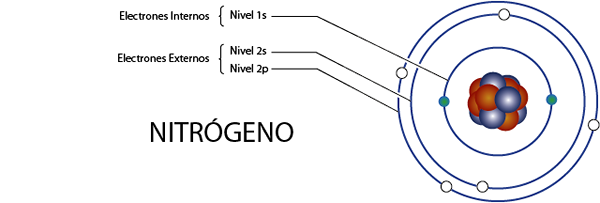
L'azote a 7 électrons au total. De plus, il appartient au groupe 5A pour ce qui contient 5 électrons de Valence, donc il a, au total 7 - 5 = 2 électrons internes.
Électrons internes de l'argon (AR)
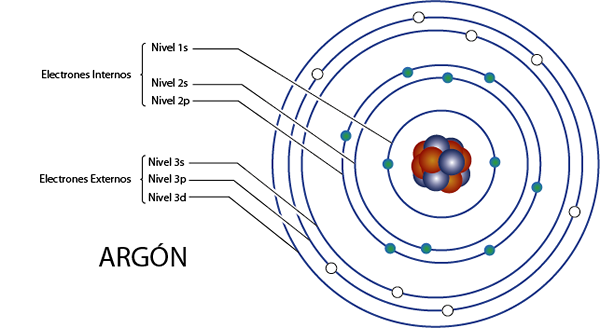
L'argon est l'élément 18 pour ce qui a 18 électrons au total. De plus, il appartient au groupe 8a pour ce qui a 8 électrons de Valence, donc il a, au total 18 - 8 = 10 électrons internes.
Électrons internes de l'ion chlorure (Cl-)
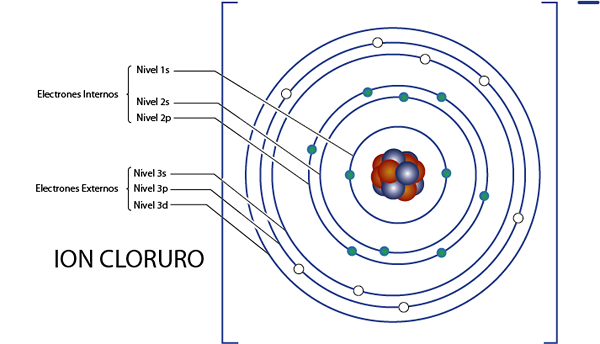
Comme nous l'avons vu il y a un instant, le chlorure a 18 électrons au total. De plus, il appartient au groupe 7A et a une charge -1, il a donc 7 - (- 1) = 8 électrons de valence. Il a donc 18 - 8 = 10 électrons internes, Comme argon.
Il peut vous servir: chimie nucléaire: histoire, domaine d'étude, zones, applicationsÉlectrons internes de calcium +2 ion (CA2+)
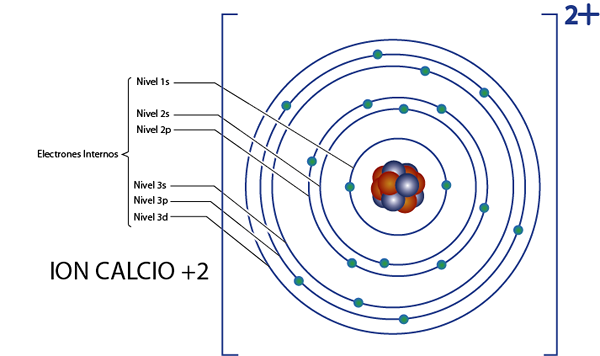
Le calcium est l'élément 20, et cet ion a 2 charges positives, donc elle a un total de 20 - 2 = 18 électrons autour du noyau. Cet élément appartient au groupe 2A et comme sa charge est +2, alors il n'a pas d'électrons de valence (2 - 2 = 0). Pour cette raison, les 18 électrons laissés par le calcium sont ceux qui étaient à l'origine les électrons internes.
Il y a deux éléments qui n'ont pas d'électrons internes
Les deux éléments plus légers du tableau périodique, qui sont l'hydrogène (H) et l'hélium (He), n'ont que 1 et 2 électrons respectivement. Les deux électrons sont au seul niveau d'énergie de ces atomes, qui est le niveau 1.
Pour cette raison, ces électrons correspondent aux électrons de valence de ces deux éléments. Comme il n'y a pas de niveaux d'énergie inférieurs, il n'y a pas non plus d'électrons internes.

