Structure Einstenio (S), propriétés, obtention, utilisations

- 3480
- 268
- Lucas Schneider
Il Einstenio C'est un élément chimique qui appartient à la classe des actinides ou des actinoïdes. Son nombre atomique est de 99 et est représenté par le symbole est. C'est un élément synthétique, car il n'a été trouvé dans aucun matériau minéral ou terrestre. Il a été découvert en 1952 dans des restes du premier test d'explosion de la pompe à hydrogène.
Les actinoïdes sont une série dont le premier membre est Actinium et fait partie des appels Éléments de transition interne. Einstenio est également le septième élément transurique, car sept places sont situées plus tard de l'uranium dans le tableau périodique des éléments.
 Symbole, nombre atomique et masse atomique standard d'Einstenio. ME / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 2.5). Source: Wikimedia Commons.
Symbole, nombre atomique et masse atomique standard d'Einstenio. ME / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 2.5). Source: Wikimedia Commons. C'est un solide très radioactif et une fois formé commence à se désintégrer la formation d'autres éléments, ce qui a rendu très difficile l'étudier. Bien que le nombre d'isotopes possibles d'Einstenio soit important, seulement moins de 20% ont été découverts.
Einstenio n'a pas d'utilisations commerciales. Il est produit en très petites quantités dans les laboratoires nucléaires et n'est destiné que pour des expériences scientifiques. De plus, les chercheurs dans de tels essais l'utilisent dans très peu de microgrammes et avec des précautions dû, car l'exposition à leur rayonnement est mortelle.
[TOC]
Nomenclature
- Einstenio, symbole chimique: c'est
- Einstenio-253, ES-253 ou 253C'est: Isotope d'Einstenio avec une masse atomique de 253.
Découverte
Origine
Cet élément a été identifié pour la première fois par Albert Ghiorso (scientifique nucléaire américain) et leurs collaborateurs en décembre 1952 dans des fragments dispersés par l'explosion thermonucléaire du premier test de pompe à hydrogène.
Cette bombe H, appelée "Ivy Mike" et aussi "La Salachicha" pour sa forme, a été explosée en novembre de la même année sur une île appartenant à un atoll de Pacific Corals.
 Explosion de pompe à hydrogène Ivy Mike. OU.S. Département de l'énergie / domaine public. Source: Wikimedia Commons.
Explosion de pompe à hydrogène Ivy Mike. OU.S. Département de l'énergie / domaine public. Source: Wikimedia Commons. Pour le détoner, une pompe à fission d'uranium avait été utilisée. Les atomes de ces derniers ont capturé plusieurs neutrons pendant l'explosion et ont subi diverses étapes de décroissance bêta, dans chacun desquels un électron et un proton sont délivrés, ce qui a conduit à la formation d'Einstenio-253, un isotope de l'ES.
Un isotope est une variante du même élément qui a un nombre différent de neutrons dans le noyau de l'atome, il a donc le même nombre atomique (dans ce cas 99) mais une masse atomique différente. Le numéro isotope indique sa masse atomique.
Il peut vous servir: trioxyde de soufre (SO3): structure, propriétés, risques, utilisationsPublication de la conclusion
Au début, le travail a été gardé secret, mais après un an, les auteurs ont décidé de le publier de peur que d'autres scientifiques indépendants puissent le produire dans d'autres laboratoires, obtenir le crédit de la découverte et attribuer le nom à l'élément.
Ainsi, de novembre 1953 à mars 1954, ils ont signalé quatre de leurs isotopes. Enfin à l'été 1955, la découverte du nouvel élément Einstenio avec le numéro atomique 99 a été annoncée.
 Les noyaux des atomes ont des protons et des neutrons. Les isotopes d'un élément sont des atomes de même qui ont un nombre différent de neutrons dans leur noyau. Auteur: Gerd Altmann. Source: Pixabay.
Les noyaux des atomes ont des protons et des neutrons. Les isotopes d'un élément sont des atomes de même qui ont un nombre différent de neutrons dans leur noyau. Auteur: Gerd Altmann. Source: Pixabay. Il est important de noter que la collecte des échantillons de l'explosion thermonucléaire a coûté la vie au premier lieutenant Jimmy Robinson, qui a été exposée au rayonnement de ces.
Sélection de noms
Le nom de "Einstenio" a été choisi parce qu'Albert Einstein a posé certaines des bases de la théorie quantique qui expliquerait alors comment les atomes interagissent les uns avec les autres.
La chose la plus importante à propos de la présence de son nom est l'application de sa célèbre équation E = MC2, qui explique la conversion de la masse en énergie dans les armes les plus destructrices créées par l'être humain.
 Albert Einstein n'est pas d'accord avec l'utilisation de la science pour créer des armes destructrices. Auteur: Stux. Source: Pixabay.
Albert Einstein n'est pas d'accord avec l'utilisation de la science pour créer des armes destructrices. Auteur: Stux. Source: Pixabay. Les auteurs de The Discovery ont suggéré que l'élément avait le symbole "E", mais en 1957, l'Union internationale de la chimie pure et appliquée, ou IUPAC (acronyme de l'anglais Union internationale de chimie pure et appliquée), a changé le symbole en "IS".
Structure électronique
Sa configuration électronique est:
1s2; 2s2 2p6; 3s2 3p6 3ddix; 4s2 4p6 4ddix 4F14; 5s2 5p6 5ddix; 6s2 6p6; 5Fonze 7s2,
ou résumé:
[RN] 5Fonze 7s2,
où [RN] est la structure électronique du gaz radon noble (qui est également radioactif).
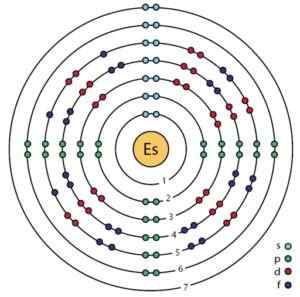 Schéma des orbitales et électrons d'un atome d'Einstenio, selon un modèle Bohr amélioré. Ahazard.ScienceWriter / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Schéma des orbitales et électrons d'un atome d'Einstenio, selon un modèle Bohr amélioré. Ahazard.ScienceWriter / CC BY-SA (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Propriétés d'Einstenio
État physique
Solide métallique à température ambiante.
Il peut vous servir: nitrate d'argent (AGNO3): structure, propriétés, utilisations, toxicitéMasse atomique
252 083
Point de fusion
860 ºC
Point d'ébullition
996 ºC
Propriétés chimiques
Études avec 253Il montre que leur comportement est celui qui est généralement observé dans un élément d'acteur trivalent, c'est-à-dire dans ses réactions Valencia +3 prédomine.
Certains des composés avec un état d'oxydation +3 ont été caractérisés, comme le chlorure (SCL3), Bromuro (ESBR3), Yoduro (ESI3), l'oxychlorure (esocl) et l'oxyde (c'est2SOIT3).
 Image d'Eintenio Yoduro prise dans l'obscurité. La lumière est causée par une émission de radioactivité. Le laboratoire national d'Alamos. / Domaine public. Source: Wikimedia Commons.
Image d'Eintenio Yoduro prise dans l'obscurité. La lumière est causée par une émission de radioactivité. Le laboratoire national d'Alamos. / Domaine public. Source: Wikimedia Commons. Cependant, des valences +2 et +4 ont également été signalées, bien qu'elles n'aient pas été confirmées. Dans ce cas, ce serait le premier métal divalent de la série Actinid.
Les données cristallographiques à la rayon x de cet élément et de ses composés sont très difficiles à obtenir car sa désintégration spontanée produit un rayonnement gamma et des rayons X qui surexposent le détecteur d'instruments et le film.
Isotopes
Jusqu'à présent, 19 isotopes des ES ont été découverts avec des masses atomiques entre 241 et 257, et 3 isomères. Aucun n'est stable. Cependant, de tous les isotopes d'Einstenio possibles ont été produits et identifiés moins de 20%.
Son isotope le plus stable est Eintenio-252, qui a une demi-vie de 471,7 jours. Berkelio-248 se désintégre à travers l'émission d'une particule alpha (formée par 2 protons et 2 neutrons) ou devient californio-252 en capturant un électron.
Courant l'obtention
De nos jours, Einstenio est produit par une longue chaîne de réactions nucléaires qui implique le bombardement de chaque chaîne isotope avec des neutrons et à la fin l'isotope résultant souffre de la décomposition bêta.
Dans la décomposition ou la délexion bêta, le noyau de l'atome émet une particule bêta, qui peut être un électron ou un positron, pour équilibrer le rapport neutron / protons dans le noyau de l'atome.
Procédure
Aux États-Unis, Oak Ridge Laboratories il y a Réacteur isotopique à flux élevé). Un microgramme est le millionième d'un gramme, c'est-à-dire qu'il équivaut à 0,000001 gramme.
Peut vous servir: thiolesLa méthode a été la suivante:
- Pendant plusieurs années de grandes quantités (kilogrammes) de 239Pu (polonio-239) pour produire 242Puan.
- Le 242PU dans l'oxyde de plutonium et mélangé avec de l'oxyde d'aluminium2SOIT3 Pour former des sphères comprimées.
- Les sphères du matériau ont été incorporées dans des bars spéciaux à irradiation pendant un an à l'usine de Savannah River aux États-Unis.
- Ensuite, les barres ont été rayonnées dans le HFIR pendant 4 mois de plus.
- Enfin, le matériau résultant a subi des procédures chimiques pour séparer l'Einstenio des isotopes de Californio (fils de l'ES).
 Noyau d'un atome. Les noyaux de polonium sont bombardés de neutrons dans le cadre de la procédure pour obtenir Einstenio. Auteur: Clker-Free-Vector-Images. Source: Pixabay.
Noyau d'un atome. Les noyaux de polonium sont bombardés de neutrons dans le cadre de la procédure pour obtenir Einstenio. Auteur: Clker-Free-Vector-Images. Source: Pixabay. Dans les opérations spéciales du HFIR, elles peuvent être obtenues jusqu'à environ 2 milligrammes (mg) d'Einstenio.
Applications
Cet élément ne s'est produit que en très petites quantités, il est également très radioactif, donc il n'a aucune utilisation commerciale. Il n'a actuellement une application que dans la recherche scientifique fondamentale.
Dans l'obtention de Mendelevio
En 1961 une quantité macroscopique de 253Il est avec un poids de 0,01 microgrammes (μg) mesuré avec un équilibre magnétique spécial. Cet échantillon a ensuite été bombardé de neutrons pour produire l'élément Mendelevio (numéro atomique 101).
Dans des études sur les effets du rayonnement
L'auto-émission intense des rayonnements d'Einstenio peut être utilisée pour étudier le vieillissement accéléré et les dommages exercés par le rayonnement.
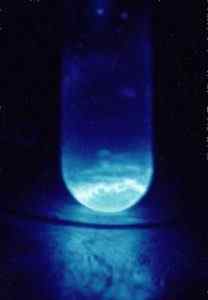 Rayonnement émis par Einstenio-253. Photo prise dans l'obscurité. Hoire, R. g., Département de l'énergie américain.Touché par des matériaux sientist en.Wikipédia. / Domaine public. Source: Wikimedia Commons.
Rayonnement émis par Einstenio-253. Photo prise dans l'obscurité. Hoire, R. g., Département de l'énergie américain.Touché par des matériaux sientist en.Wikipédia. / Domaine public. Source: Wikimedia Commons. Par exemple, il a été utilisé dans des études sur les conséquences chimiques de la désintégration radioactive.
En raison de la demi-vie relativement courte de l'ES-253 (20,47 jours), vous pouvez étudier à la fois la croissance interne de son fils sonotopo BK-249, dont la demi-vie est de 330 jours, et celle du petit-fils CF-249 (Life moyenne de 351 ans).
Certaines données suggèrent qu'il est un divalent pourrait refuser un caliporn divalent divalent (toujours inconnu).
Dans des études chimiques et physicochimiques
C'est l'élément le plus lourd avec lequel des études peuvent être menées qui permettent le développement d'une recherche fondamentale sur le rôle que les électrons 5F Dans l'organisation et la classification des actinides.
ES-252 est disponible uniquement en quantités minimales. Les isotopes ES-253 (demi-vie 20,47 jours) et ES-254 (275,7 jours) ont une demi-vie plus longue et en ont une plus grande disponibilité, ils sont donc utilisés dans les études physicochimiques.
Cependant, seuls quelques microgrammes (μg) sont utilisés dans des expériences pour réduire l'exposition des travailleurs et minimiser les effets de l'auto-irradiation intense.
 Einstenio est très dangereux car c'est un élément puissamment radioactif. Auteur: Clker-Free-Vector-Images. Source: Pixabay.
Einstenio est très dangereux car c'est un élément puissamment radioactif. Auteur: Clker-Free-Vector-Images. Source: Pixabay. Utilisation potentielle en médecine
On estime qu'il pourrait être utilisé pour les traitements médicaux de radiation destinés à certains organes.
Les références
- Diriger, D.R. (éditeur) (2003). CRC Handbook of Chemistry and Physics. 85e CRC Press.
- PubChem (2020). Einsteinium - est (élément). Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- Meierfrankenfeld, D. et al. (2011). Découverte des isotopes du scandium, du titane, du mercure et de l'einsteinium. Données atomiques et tableaux de données nucléaires 97 (2011) 134-151. Récupéré de ScienceDirect.com.
- Société royale de chimie. (2020). Einsteinium. RSC a récupéré.org.
- Ross, R. (2017). Faits sur Einsteinium. Récupéré de la lue.com.
- « Caractéristiques et exemples des entreprises mixtes
- Caractéristiques du marché cible, types, comment le définir, exemples »

