Parties et exemples d'équations chimiques
- 1812
- 174
- Prof Noah Collet
La Équation chimique Il s'agit d'une représentation schématique de certaines des caractéristiques d'une réaction chimique. On peut également dire que l'équation chimique décrit les changements subis par les différentes substances impliquées dans une réaction.
Dans l'équation chimique, les formules et les symboles des différentes substances participants sont placés, pointant clairement le nombre d'atomes de chaque élément présent dans les composés, qui apparaît comme un indice et ne peut pas être modifié lors de l'équilibre de l'équation.
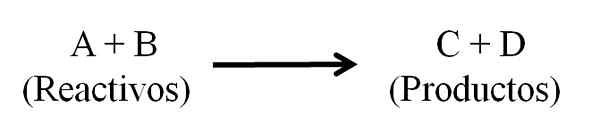
 Équation chimique générale pour une réaction chimique. Réactifs et produits. Source: Gabriel Bolívar.
Équation chimique générale pour une réaction chimique. Réactifs et produits. Source: Gabriel Bolívar. L'équation chimique doit apparaître équilibrée, c'est-à-dire que le nombre d'atomes des réactifs et des produits doit être le même. De cette façon, la loi de la conservation de la matière est obéi. Il est souhaitable que les nombres utilisés pour équilibrer les équations soient des nombres entiers.
Ces équations ne révèlent pas des étapes consécutives, ni pourquoi les réactifs des mécanismes sont transformés en produits.
C'est pourquoi bien qu'ils soient très utiles pour comprendre où se déroule une réaction chimique, elle ne permet pas de comprendre ses aspects moléculaires ou comment ils sont affectés par certaines variables; comme le pH, la viscosité, le temps de réaction, la vitesse d'agitation, entre autres.
[TOC]
Parties d'une équation chimique
Fondamentalement, il y a trois pièces principales dans une équation chimique: les réactifs, les produits et la flèche qui indiquent la signification de la réaction chimique.
Emplacement des réactifs et des produits
Dans l'équation chimique, toutes les substances qui fonctionnent comme des réactifs et tous ceux qui sont des produits apparaissent. Ces groupes de substances sont séparés par une flèche qui indique la signification de la réaction. Les réactifs sont situés à gauche de la flèche et les produits à droite.
La flèche signifie ce qui est produit et est orienté de gauche à droite (→), bien que dans les réactions réversibles, il existe deux flèches équivalentes et parallèles; l'un a dirigé vers la droite, et un autre à gauche. Le symbole (δ) est généralement placé sur la flèche, indiquant que la chaleur a été utilisée dans la réaction.
Peut vous servir: terpenosDe plus, l'identification du catalyseur est généralement placée sur la flèche, si possible avec sa formule ou son symbole. Les différentes substances qui apparaissent sous forme de réactifs sont séparées par signe (+), indiquant que les substances réagissent ou se combinent entre elles.
Dans le cas des substances qui apparaissent sous forme de produits, Sign (+) n'a pas la connotation précédente; À moins que la réaction ne soit réversible. Il est pratique que le signe (+) soit placé équidistant des substances qui se séparent.
Équation des équations chimiques
Il est essentiel que les équations chimiques soient correctement équilibrées. Pour cela, un nombre appelé coefficient stoichiométrique est placé. Chaque fois que nécessaire, ce coefficient doit aller devant les substances qui apparaissent comme réactifs ou produits.
Il s'agit de s'assurer que le nombre de tous les atomes des éléments qui apparaissent comme réactifs est exactement égal au nombre d'entre eux qui apparaissent dans le produit. La méthode des équations chimiques les plus simples est celle de Tanteo.
États physiques des composants de l'équation chimique
Dans certaines équations chimiques, l'état physique des substances est indiqué par une sous-industrie. Pour cela, les abréviations suivantes sont utilisées en espagnol: (s) pour l'état solide; (l) pour l'état liquide; (g), état gazeux; et (AC), solution aqueuse.
Exemple: réaction de carbonate de calcium avec l'acide chlorhydrique.
Voleur3 (s) + 2 HCl(AC) → CACL2 (s) + H2SOIT(L) + CO2 g)
Modifications de l'état physique
Dans certains cas, il est indiqué dans l'équation chimique s'il y a une production d'un gaz dans la réaction chimique ou s'il y a la précipitation de l'une des substances produites.
Peut vous servir: sels binairesLa présence d'un gaz est indiquée par une flèche verticale avec son extrémité dirigée vers le haut (↑), placée sur le côté droit de la substance gazeuse.
Exemple: réaction de zinc avec l'acide chlorhydrique.
Zn +2 HCl → Zncl2 + H2↑
Si dans la réaction chimique, l'une des substances forme un précipité, ceci est symbolisé en plaçant une flèche verticale avec son extrémité dirigée vers le bas (↓), placée sur le côté droit de la substance précipitée.
Exemple: réaction d'acide chlorhydrique avec du nitrate d'argent.
HCL + Agno3 → HNO3 + AGCL ↓
Exemple d'équations chimiques
- Photosynthèse
 Équation de la photosynthèse
Équation de la photosynthèse La photosynthèse est un processus par lequel les plantes capturent et transforment l'énergie lumineuse, de la lumière du soleil, pour générer l'énergie nécessaire à leur subsistance. La photosynthèse est réalisée par des organites typiques des cellules végétales appelées chloroplastes.
Dans la membrane chloroplastique se trouvent des tilacoïdes, des endroits où se trouvent les chlorophylles pour et b, qui sont les principaux pigments qui capturent l'énergie lumineuse.
Bien que la photosynthèse soit un processus complexe, il peut être schématique dans l'équation chimique suivante:
6 CO2 + 6 h2O → C6H12SOIT6 + 6 o2↑ ΔGº = 2.870 kJ / mol
C6H12SOIT6 C'est la formule du glucose, les glucides métabolisés pour la production d'ATP; Composé qui est le principal réservoir d'énergie dans la plupart des êtres vivants. De plus, à partir du glucose NADPH est généré, coenzyme nécessaire pour de nombreuses réactions.
- Respiration cellulaire
Les cellules utilisent l'oxygène pour le métabolisme de nombreuses substances présentes dans les aliments ingérés. Pendant ce temps, l'ATP est utilisé comme source d'énergie des activités menées par les êtres vivants, produisant dans ces processus du dioxyde de dioxyde et de l'eau.
Peut vous servir: acétate d'aluminium (AL (CH3COO) 3): Structure, propriétés, utilisationsSi le glucose est utilisé comme modèle de substance métabolisé, la respiration peut être schématique par l'équation chimique suivante:
C6H12SOIT6 + 6 o2 → 6 CO2 + 6 h2SOIT
- Réactions d'éléments communs
Réaction de décomposition
Un composé ou des composés se dissocie (n) se formant avec ses atomes d'autres composés différents:
2 kclo3 (s) → 2 kCl(S) + 3 o2 g)
Réaction de déplacement
Un métal réagit avec un composé remplaçant un métal présent dans ceci:
Mg(S) + Cuso4 (AC) → Cu(S) + MGSO4 (AC)
Réaction d'élimination
Dans ce type de réaction, le nombre d'atomes ou de groupes attachés à un atome de carbone:
Ch3-Ch2Br + naoh → h2C = ch2 + H2O + Nabr
Réaction d'hydratation
C'est une réaction dans laquelle un composé ajoute une molécule d'eau. Cette réaction est importante dans la préparation des alcools:
H2C = ch2 + H2O → H2C-ch2Oh
Réaction de neutralisation
Une base ou l'alcali réagit avec un acide produisant un sel et une eau:
HCL(AC) + Naoh(AC) → NaCl(AC) + H2SOIT(L)
Réaction de synthèse
Dans ce type de réaction, deux substances ou plus sont combinées pour provoquer un nouveau composé:
2 li(S) + CL2 g) → 2 LICL(S)
Réaction à double déplacement (métathèse)
Dans ce type de réaction, il y a l'échange d'ions positifs et négatifs pour former de nouveaux composés:
Agno3 (AC) + NaCl(AC) → AGCL(S) + Grand frère3 (AC)
Les références
- Fleurs, J. (2002). Chimie. Édition 1était. Éditorial de Santillana
- Mathews, C. K., Van Holde, K. ET., Et ahern, k. g. (2002). Biochimie. 3était Édition. Pearson Addison Wesley Editorial
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2019). Équation chimique. Récupéré de: dans.Wikipédia.org
- Helmestine, Anne Marie, Ph.D. (20 septembre 2019). Qu'est ce qu'une equation chimique? Récupéré de: Thoughtco.com
- « Concept et formule du volume molaire, calcul et exemples
- Challenger Abyss Geological Formation, Location, Caractéristiques »

