Structure de disulfure de carbone (CS2), propriétés, utilisations, risques
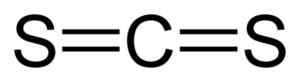
- 3173
- 719
- Jade Duval
Il le disulfure de carbone Il s'agit d'un composé formé par l'union d'un atome de carbone (C) et de deux atomes de soufre (s). Sa formule chimique est CS2. C'est un liquide incolore ou légèrement jaune avec une odeur désagréable en raison des impuretés qu'il contient (composés de soufre). Lorsque pure son odeur est douce et douce, similaire au chloroforme ou à l'éther.
Il provient naturellement de l'action du soleil sur les molécules organiques trouvées dans l'eau de mer. De plus, il se produit dans les eaux des marécages et est également expulsé des volcans ainsi que d'autres gaz.
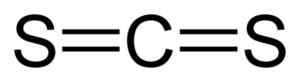 Disulfure de carbone CS2. Auteur: Benjah-bmm27. Source: Wikimedia Commons.
Disulfure de carbone CS2. Auteur: Benjah-bmm27. Source: Wikimedia Commons. Le disulfure de carbone est un liquide volatil et est également très inflammable, il doit donc être tenu à l'écart des flammes et des étincelles ou des appareils qui peuvent les produire, y compris les ampoules électriques.
Il a la capacité de dissoudre un grand nombre de composés, de matériaux et d'éléments, tels que le phosphore, le soufre, le sélénium, les résines, les laques, etc. Par conséquent, il trouve l'utilité comme solvant.
Il est également intermédiaire dans diverses réactions chimiques industrielles, telles que la production de rayonne ou la soie artificielle.
Il doit être manipulé avec prudence et avec des outils de protection car il est très toxique et dangereux.
[TOC]
Structure
Le disulfure de carbone a un atome de carbone et deux atomes de soufre sur les côtés.
Les liens entre l'atome de carbone et les atomes de soufre sont covalents et doubles, donc ils sont très forts. La molécule CS2 Il a une structure linéaire et symétrique.
 Structure linéaire du disulfure de carbone CS2. Noir = carbone, jaune = soufre. Auteur: Benjah-bmm27. Source: Wikimedia Commons.
Structure linéaire du disulfure de carbone CS2. Noir = carbone, jaune = soufre. Auteur: Benjah-bmm27. Source: Wikimedia Commons. Nomenclature
- Le disulfure de carbone
- Bisulfure de carbone
- Anhydride ditiocarbonique
Propriétés
État physique
Incolore à jaunâtre.
Poids moléculaire
76,15 g / mol
Point de fusion ou de solidification
-110,8 ° C
Point d'ébullition
46,0 ºC
Point d'inflammation
-30 ºC (méthode de tasse fermée).
Température d'auto-direction
90 ° C
Densité
Liquide = 1,26 g / cm3 à 20 ºC.
Steam = 2,67 fois l'air.
Ses vapeurs sont plus que doubles que l'air et le liquide sont plus lourds que l'eau.
La pression de vapeur
279 mmHg à 25 ° C.
Peut vous servir: hypochlorite de potassium (kclo)Ceci est une pression à grande vapeur.
Solubilité
Très peu d'eau soluble: 2,16 g / L A 25 ° C. Soluble dans le chloroforme. Miscible avec de l'éthanol, du méthanol, de l'éther, du benzène, du chloroforme et du tétrachlorure de carbone.
Propriétés chimiques
Le CS2 Il s'évapore facilement à température ambiante car son point d'ébullition est très faible et sa pression de vapeur est très élevée.
Le disulfure de carbone est extrêmement inflammable. Ses vapeurs sont très facilement enflammées, même avec la chaleur d'une ampoule électrique. Cela signifie qu'il réagit très rapidement avec l'oxygène:
CS2 + 3 o2 → CO2 + 2 Alors2
Le fait que vous ayez une pression de vapeur élevée à température ambiante rend dangereux d'être proche d'une flamme.
Lorsqu'il est chauffé à la décomposition peut facilement exploiter, émettre des gaz toxiques à partir d'oxydes de soufre. Au-dessus de 90 ° C, il est allumé spontanément.
Il se décompose lorsqu'il est stocké pendant longtemps. Attaquer le cuivre et ses alliages. Il réagit également avec des plastiques, des caoutchoucs et des revêtements.
Réagit dans certaines conditions avec de l'eau, formant un sulfure carbonyle OCS, le dioxyde de charbon2 et disulfure d'hydrogène H2S:
CS2 + H2O → OCS + H2S
CS2 + 2 h2O → CO2 + 2 h2S
Avec des alcools (ROH) dans le milieu alcalin forme des xantates (ro-cs-nna):
CS2 + Roh + naoh → h2Ou + ro-c (= s) -sna
Obtention
Le disulfure de carbone est préparé commercialement par réaction de soufre avec le charbon. Le processus est effectué à des températures de 750-900 ° C.
C + 2 S → CS2
Au lieu du charbon, vous pouvez également utiliser du méthane ou du gaz naturel, et même l'éthane, le propane et le propylène ont été utilisés, auquel cas la réaction se produit à 400-700 ° C avec des performances élevées.
Il peut également être préparé en réagissant au gaz naturel avec du sulfure d'hydrogène H2S une température très élevée.
Présence dans la nature
Le CS2 C'est un produit naturel présent dans l'atmosphère en très petites quantités (traces). Il se produit photochimiquement dans les eaux de surface.
L'action de la lumière du soleil sur certains composés présents dans l'eau de mer comme la cystéine (un acide aminé) entraîne une formation de disulfure de carbone.
 Le disulfure de carbone peut être formé par l'action des rayons solaires sur certains composés organiques présents dans l'eau de mer. Auteur: Pexels. Source: Pixabay.
Le disulfure de carbone peut être formé par l'action des rayons solaires sur certains composés organiques présents dans l'eau de mer. Auteur: Pexels. Source: Pixabay. Il est également naturellement libéré pendant les éruptions volcaniques et se trouve en petites quantités sur les marécages.
Peut vous servir: benzaldéhydeNormalement, nous sommes exposés à respirer dans de très petites proportions et nous sommes présents dans certains aliments. On le trouve également dans la fumée des cigarettes.
Dans l'environnement, il se décompose à travers la lumière du soleil. Au sol, il se déplace à travers. Certains micro-organismes du sol se décomposent.
Applications
Dans l'industrie chimique
Le disulfure de carbone est un composé chimique important car il sert à préparer d'autres produits chimiques. Peut agir comme un intermédiaire chimique.
Il est également utilisé comme solvant de processus par exemple pour dissoudre le phosphore, le soufre, le sélénium, le brome, l'iode, les graisses, les résines, les cires, les laques et les caoutchoucs.
Permet la fabrication de produits pharmaceutiques et d'herbicides, entre autres.
Dans la production de Rayón et Celofán
Avec cs2 Les xantatos sont préparés qui sont des composés utilisés dans la fabrication de Rayón et Celofán.
Pour obtenir de la soie artificielle ou de la rayonne, elle est basée sur la cellulose qui est traitée avec des alcalines et un disulfure de carbone CS2 et se transforme en cellulose xantate, soluble en alcali. Cette solution est visqueuse et est donc appelée "Viscosa".
La viscose est faite sous pression à travers de très petits trous à l'intérieur d'un bain acide. Ici, la cellulose xantate est à nouveau transformée en cellulose qui est insoluble et longs et brillants.
Les fils ou les filaments peuvent être tournés pour donner un matériel connu sous le nom de Rayón.
(1) cellulose + naOH → Alcali-Celulosa
Roh + Naoh → Rona
(2) alcalin-celose + disulfure de carbone → cellulose xantate
Rona + S = C = S → Ro-C (= S) -SNA
(3) xantate de cellulose + acide → cellulose (filaments)
Ro-c (= s) -sna + acide → roh
 Vêtements en rayonne, fibre dont la fabrication participe au disulfure de carbone. Tobias "Take" Maier [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons.
Vêtements en rayonne, fibre dont la fabrication participe au disulfure de carbone. Tobias "Take" Maier [cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0)]. Source: Wikimedia Commons. Si la cellulose est précipitée en passant le Xantato à travers une fente étroite, la cellulose est régénérée sous la forme de feuilles minces qui composent le cellophane. Ceci est adouci de glycérol et est utilisé comme film de protection d'objet.
 Le cellophane est fabriqué à l'aide d'un disulfure de carbone. Auteur: Hans Braxmeier. Source: Pixabay.
Le cellophane est fabriqué à l'aide d'un disulfure de carbone. Auteur: Hans Braxmeier. Source: Pixabay. Dans la production de tétrachlorure de carbone
Le disulfure de carbone réagit avec le chlore Cl2 Pour donner du tétrachlorure de carbone CCL4, qui est un solvant important qui n'est pas du carburant.
Peut vous servir: chlorobenzène (C6H5CL)CS2 + 3 CL2 → CCL4 + S2CL2
Dans plusieurs applications
Le disulfure de carbone participe à la vulcanisation froide du caoutchouc.
Les xantatos préparés avec CS2 Ils sont utilisés dans la flottation minérale.
Anciennes utilisations
Le CS2 C'est un poison pour les organismes vivants. Auparavant, il a été utilisé pour détruire les ravageurs tels que les rats, les marmotes et les fourmis, versant le liquide dans tous les espaces fermés dans lesquels ces animaux vivaient (terriers et hormigueros))).
Lorsque les vapeurs toxiques denses ont été utilisées à cet effet, ils ont mis fin à tous les organismes vivants qui se trouvaient dans l'espace confiné.
Il a également été utilisé comme antihelmintine pour les animaux et pour éliminer les larves des moscardons de l'estomac des chevaux.
Dans l'agriculture, il a été utilisé comme insecticide et nématicide, pour fumiger le sol, à la fumigation des pépinières, des granges, des silos et des moulins de céréales. Les voitures de chemin de fer, les navires et les barges ont également été fumigés.
 Agriculteur en 1904 fumigation du sol avec un disulfure de carbone pour lutter contre une peste de plantes de raisin. Ölgemälde von Hans Pühringer, 1904 [Gfdl 1.2 (http: // www.gnou.Org / licences / anciens licences / fdl-1.2.html)]. Source: Wikimedia Commons.
Agriculteur en 1904 fumigation du sol avec un disulfure de carbone pour lutter contre une peste de plantes de raisin. Ölgemälde von Hans Pühringer, 1904 [Gfdl 1.2 (http: // www.gnou.Org / licences / anciens licences / fdl-1.2.html)]. Source: Wikimedia Commons. Toutes ces utilisations ont été interdites en raison de la forte inflammabilité et de la toxicité du CS2.
Des risques
Le CS2 C'est très inflammable. Beaucoup de vos réactions peuvent provoquer du feu ou de l'explosion. Les mélanges de leurs vapeurs avec de l'air sont explosifs. Lorsque l'inflammation produit des gaz irritants ou toxiques.
Le disulfure de carbone pour les drains ne doit pas être versé, car dans les tubes, il y a un mélange de cs2 et l'air qui peut provoquer une explosion s'il est allumé par accident.
Ses vapeurs tirent spontanément en contact avec des étincelles ou des surfaces chaudes.
Le disulfure de carbone irrite sévèrement les yeux, la peau et les muqueuses.
Si le système nerveux central est inhalé ou ingéré sérieusement, le système cardiovasculaire, les yeux, les reins et le foie. Il peut également être absorbé par la peau causant des dommages.
Les références
- OU.S. Bibliothèque nationale de médecine. (2020). Carbone disulfure. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Mopper, k. Et Kieber, D.J. (2002). Photochimie et cyclisme du carbone, du soufre, de l'azote et du posphère. En biogéochérité de la matière organique dissoute marine. Récupéré de ScienceDirect.com.
- Meyer, B. (1977). Utilisations industrielles du soufre et de ses baisses. Carbone disulfure. En soufre, énergie et envie. Récupéré de ScienceDirect.com.
- Pohanish, R.P. (2012). C. Carbone disulfure. Dans le manuel de Sittig de produits chimiques et cancérogènes toxiques et dangereux (sixième édition). Récupéré de ScienceDirect.com.
- Morrison, R.T. Et Boyd, R.N. (2002). Chimie organique. 6e édition. Prentice Hall.
- Windholz, M. et al. (éditeurs) (1983). L'indice Merck. Une enyclopédie des produits chimiques, des médicaments et des biologiques. Dixième édition. Merck & Co., Inc.
- « Les 95 meilleures phrases des saints catholiques
- +105 phrases catholiques sur la foi, la réflexion, la prière et l'espoir »

