Dénaturation des protéines ce qui est, facteurs, conséquences
- 1843
- 159
- Adrien Remy
Quelle est la dénaturation des protéines?
La dénaturation des protéines Il se compose de la perte de structure à trois dimensions en raison de différents facteurs environnementaux, tels que la température, le pH ou certains agents chimiques. La perte de la structure entraîne la perte de la fonction biologique associée à cette protéine, qu'elle soit enzymatique, structurelle, transporteur, entre autres.
La structure de la protéine est très sensible aux changements. La déstabilisation d'un seul pont hydrogène essentiel peut dénaturaliser la protéine. De la même manière, il existe des interactions qui ne sont pas strictement essentielles pour remplir la fonction des protéines et, en cas de déstabilisation, cela n'a aucun effet sur le fonctionnement.
Structure des protéines
Afin de comprendre les processus de dénaturation des protéines, nous devons savoir comment les protéines sont organisées. Ceux-ci ont une structure primaire, secondaire, tertiaire et quaternaire.
Structure primaire
C'est la séquence d'acides aminés qui composent cette protéine. Les acides aminés sont les blocs fondamentaux qui constituent ces biomolécules et il existe 20 types différents, chacun avec des propriétés physiques et chimiques particulières. Ils se réunissent au moyen d'un lien peptidique.
Structure secondaire
Dans cette structure, cette chaîne linéaire d'acides aminés commence à être pliée par des ponts d'hydrogène. Il existe deux structures secondaires de base: l'hélice α, en forme de spirale; et la feuille de pliage β, lorsque deux chaînes linéaires sont alignées en parallèle.
Structure tertiaire
Il s'agit d'autres types de forces qui se traduisent par un pliage spécifique de la forme à trois dimensions.
Les chaînes R des résidus d'acides aminés qui composent la structure de la protéine peuvent former des ponts disulfure et les parties hydrophobes des protéines sont regroupées à l'intérieur, tandis que les hydrophiliques font face à l'eau à l'eau. Les forces de van der Waals agissent comme un stabilisateur des interactions décrites.
Peut vous servir: isoleucine: caractéristiques, fonctions, biosynthèse, nourritureStructure quaternaire
Il se compose d'agrégats d'unités protéiques.
Lorsqu'une protéine est dénaturée, elle perd la structure quaternaire, tertiaire et secondaire, tandis que le primaire reste intact. Les protéines riches en liaisons disulfure (structure tertiaire) donne une plus grande résistance à la dénaturation.
Facteurs qui provoquent la dénaturation
Tout facteur qui déstabilise les liaisons non covalentes responsables du maintien de la structure native de la protéine peut produire sa dénaturation. Parmi les plus importants que nous pouvons mentionner:
pH
Aux valeurs de pH très extrêmes, que ce soit des moyens acides ou de base, la protéine peut perdre sa configuration à trois dimensions. Les excès de cils h+ et oh- Au milieu déstabilise les interactions protéiques.
Ce changement de modèle d'ions produit une dénaturation. La dénaturation du pH peut être réversible dans certains cas et dans d'autres irréversibles.
Température
La dénaturation thermique se produit en augmentant la température. Dans les organismes qui vivent dans des conditions environnementales moyennes, les protéines commencent à se déstabiliser à des températures supérieures à 40 ° C. De toute évidence, les protéines d'organisme thermophile peuvent soutenir ces plages de température.
Les augmentations de température sont traduites en augmentation des mouvements moléculaires qui affectent les ponts d'hydrogène et d'autres liaisons non covalentes, entraînant la perte de structure tertiaire.
Ces augmentations de température entraînent une vitesse de réaction, si nous parlons d'enzymes.
Produits chimiques
Substances polaires - comme l'urée - à des concentrations élevées affectent les ponts d'hydrogène. De même, les substances non polaires peuvent avoir des conséquences similaires.
Les détergents peuvent également déstabiliser la structure des protéines; Cependant, ce n'est pas un processus agressif et ils sont surtout réversibles.
Peut vous servir: cafard allemand: caractéristiques, reproduction, nourritureLes agents réducteurs
Le β-mercaptoetanol (HOCH2CH2SH) est un agent chimique à usage fréquent en laboratoire pour dénaturer les protéines. Il est responsable de la réduction des ponts disulfure entre les déchets d'acides aminés. Peut déstabiliser la structure tertiaire ou quaternaire de la protéine.
Un autre agent réducteur avec des fonctions similaires est le ditiotréitol (DTT). De plus, d'autres facteurs qui contribuent à la perte de structure native dans les protéines sont des métaux lourds à des concentrations élevées et un rayonnement ultraviolet.
Conséquences du dénaturation des protéines
Lorsque la dénaturalisation se produit, la protéine perd sa fonction. Les protéines fonctionnent de manière optimale lorsqu'elles sont dans leur état d'origine.
La perte de la fonction n'est pas toujours associée à un processus de dénaturation. Un petit changement dans la structure des protéines peut entraîner la perte de fonction sans déstabiliser la structure entière à trois dimensions.
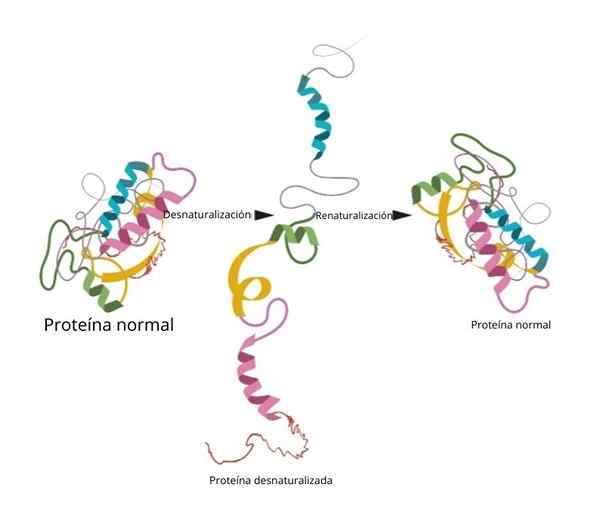
Le processus peut ou non être irréversible. En laboratoire, si les conditions sont inversées, la protéine revient à sa configuration initiale.
Renaturalisation
L'une des expériences les plus célèbres et les plus concluantes sur la renaturalisation a été mise en évidence dans la ribonucléase pour.
Lorsque les chercheurs ont ajouté des agents dénaturés tels que l'urée ou le β-mercaptanol, la protéine a été dénaturée. Si ces agents étaient retirés, la protéine est revenue à leur conformation native et pourrait remplir leur fonction avec une efficacité à 100%.
L'une des conclusions les plus importantes de cette recherche a été de démontrer expérimentalement que la conformation à trois dimensions de la protéine est donnée par sa structure principale.
Dans certains cas, le processus de dénaturalisation est totalement irréversible. Par exemple, lorsque nous cuisinons un œuf, nous appliquons la chaleur dans les protéines (la principale est l'albumine) qui la constituait, le clair prend une apparence solide et blanchâtre. Intuitivement peut conclure que, bien que nous le refroidissions, il ne reviendra pas à sa forme initiale.
Peut vous servir: ovogenèse: phases, caractéristiques des animaux et des plantesDans la plupart des cas, le processus de dénaturalisation s'accompagne d'une perte de solubilité. Viscosité, la vitesse de diffusion est également réduite et cristallise plus facilement.
Protéines Chaperonas
Chaperonas ou les protéines de chaperonine sont responsables de la prévention de la dénaturation d'autres protéines. Ils répriment également certaines interactions qui ne sont pas adéquates entre les protéines pour en assurer un pliage correct.
Lorsque la température moyenne augmente, ces protéines augmentent leur concentration et agissent en empêchant la dénaturation d'autres protéines. C'est pourquoi ils sont également appelés "protéines de choc thermique" ou HSP pour son acronyme en anglais (Protéines de choc thermique).
Les chaperonins sont analogues à une cage ou un baril qui protège la protéine d'intérêt à l'intérieur.
Ces protéines qui répondent aux situations de stress cellulaire ont été rapportées dans divers groupes d'organismes vivants et sont très préservés. Il existe différents types de chaperonins et sont classés en fonction de leur poids moléculaire.

