Historique de la caméra Neubauer, caractéristiques, utilisations

- 2165
- 431
- Prof Noah Collet
La Caméra Neubauer, Fumiméter ou héchocytomètre, est un instrument de laboratoire qui se compose d'une plaque de verre spéciale. Cette chambre sert à effectuer certains types de cellules tels que les globules rouges, les globules blancs et les plaquettes, bien qu'il puisse être utilisé pour compter les spores, les spermatozoïdes, les parasites, etc.
Il présente des caractéristiques très particulières, car il se compose de 3 zones, un centre pour le décompte et deux zones de soutien. Chaque caméra a deux zones de comptage ou réticules, une en haut et une en bas.
 Caméra Neubauer. Source: Santibadia [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Image édité.
Caméra Neubauer. Source: Santibadia [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Image édité. Ceux-ci ont plusieurs divisions sous forme de grille. Les zones de comptage sont les boîtes moyennes trouvées dans les 4 coins des deux réticules, plus le carré central.
L'assemblage de la caméra doit être effectué très attentivement, car tout détail influence le nombre de cellules. Il y a beaucoup d'erreurs qui peuvent être commises, mais si l'une d'entre elles se produit, la caméra doit être démontée, propre et ré-assemblée. Parmi les principales erreurs, ce qui suit peut être mentionné:
Rebosar la caméra ou faire une garniture insuffisante, laisser la caméra sécher, essayer de retirer l'excès de liquide avec de la gaze, incliner la caméra en le transportant, en remplissant une caméra sale ou humide, et sans mélanger la dilution ou bien l'échantillon, entre autres. Toutes ces erreurs entraîneront une valeur irréelle.
[TOC]
Histoire
La caméra de Neubauer est un instrument de précision, et dans le processus de fabrication, il passe par un contrôle de qualité strict. Il a été créé pour des particules ou des formes précises par mm3, comme les cellules dans divers liquides. Ses graphismes délicats sont sculptés avec un crayon en diamant.
Caractéristiques de la chambre Neubauer
La caméra complète est de la taille d'une diapositive normale afin qu'elle puisse être placée sur la plaque de microscope.
La caméra se compose de trois surfaces rectangulaires centrales (A, B, C). Dans la zone «B», la zone R ou Count est située, également appelée réticulum. Un de chaque côté de la caméra, séparé par la zone «d».
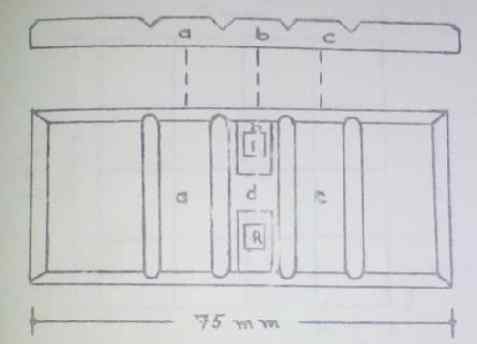 Schéma graphique de la caméra Neubauer. Source: Guide de l'hématologie pratique. École de bioanalyse de l'Université de Carabobo, Venezuela.
Schéma graphique de la caméra Neubauer. Source: Guide de l'hématologie pratique. École de bioanalyse de l'Université de Carabobo, Venezuela. Chaque réticulum est une zone polie qui contient la zone de contribution gravée. Il se compose d'un carré avec une superficie de 9 mm2 Et il est divisé en interne en 9 images avec 1 mm2 surface. Les quatre coins sont divisés en 16 grilles plus petites (0.0625 mm2 De surface).
Ces grilles sont formées par une série de lignes millimétriques qui se croisent les unes avec les autres, constituant des grilles parfaitement graphiques et délimitées aux mesures spécifiées. Ces lignes ont été enregistrées avec une pointe de diamant.
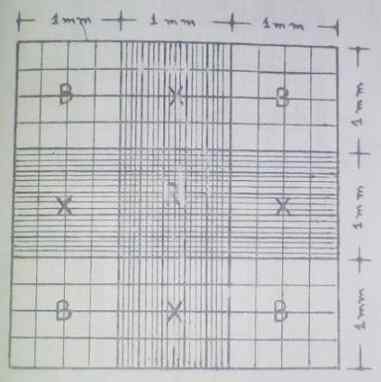 Réticulum Neubauer amélioré. Source: Guide de l'hématologie pratique de l'École de bioanalyse de l'Université de Carabobo, Venezuela.
Réticulum Neubauer amélioré. Source: Guide de l'hématologie pratique de l'École de bioanalyse de l'Université de Carabobo, Venezuela. Les quatre côtés correspondent à la zone de comptage. Dans ces côtés ou coins, c'est là que le compte de la plupart des cellules (globules rouges et leucocytes) est effectué, tandis que les plaquettes sont comptées dans la zone centrale.
Peut vous servir: malachite vert: caractéristiques, préparation, applications, toxicitéLa zone centrale a plus de divisions, elle se compose d'un carré de 1 mm2 divisé en 25 peintures qui ont une superficie de 0,04 mm2 chacun. Ceux-ci sont à leur tour divisés en 16 grilles avec une superficie de 0,0025 mm2.
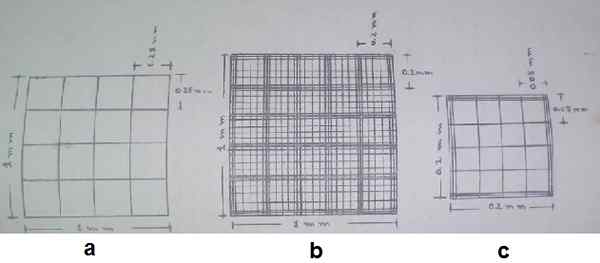 Description du réticulum Neubauer amélioré. a) carré des coins, b) carré central, c) carré moyen du carré central. Source: Guide de l'hématologie pratique de l'École de bioanalyse de l'Université de Carabobo, Venezuela.
Description du réticulum Neubauer amélioré. a) carré des coins, b) carré central, c) carré moyen du carré central. Source: Guide de l'hématologie pratique de l'École de bioanalyse de l'Université de Carabobo, Venezuela. La zone «A» et «C» sert de soutien pour placer des couvertures d'objets spéciales qui s'appelle les couvertures hématimétriques de lamelle ou d'hématimètre.
La hauteur entre la lamelle et la surface de comptage est de 0,1 mm. Les mesures de surface des boîtes de comptage, ainsi que la hauteur de la caméra et la dilution de l'échantillon, sont les données nécessaires pour effectuer les calculs finaux.
Applications
Il est utilisé pour le nombre de cellules. Surtout, il est très utile dans le domaine de l'hématologie, car il permet de faire les 3 séries de cellules sanguines; c'est-à-dire les globules rouges, les globules blancs et les plaquettes.
Cependant, il peut être utilisé dans d'autres domaines, par exemple pour compter les spermatozoïdes, les spores, les bactéries ou d'autres éléments importants en fonction du type d'échantillon.
Comment on l'utilise?
La préparation des échantillons
Pour effectuer le nombre de cellules, il commence généralement à partir d'une dilution précédente. Exemple: Pour compter les globules blancs, une dilution 1:20 est préparée avec un liquide turc. La dilution est bien mélangée avant de charger la pipette et de configurer la caméra Neubauer.
Il y a des occasions où une dilution 1:20 ne suffit pas pour compter. Par exemple, chez les patients souffrant de certains types de leucémies chroniques. Dans ces cas, des dilutions plus élevées doivent être faites 1: 100.
Si au contraire, le compte est très faible, comme dans les leucopénias sévères, des dilutions plus petites peuvent être faites pour concentrer l'échantillon. Exemple: vous pouvez faire une dilution 1:10.
Les modifications qui sont apportées influencent les calculs.
Assemblage de la chambre Neubauer
La chambre de Neubauer est assemblée en plaçant la lamelle hématimétrique dans la zone centrale. Les deux doivent être très propres et secs. Pour placer la lamella, il est pris par les bords et tombe doucement sur la caméra.
Ceci est rempli en plaçant la pointe d'une pipette automatique ou d'une pipette Thoma à un angle de 35 ° sur le bord de la zone de cargaison. Le liquide est déchargé doucement et la zone de chargement est remplie par capillarité. Cela se fait des deux côtés pour charger les deux reticules.
Aucun reticules ne doit être surchargé et le liquide ne doit pas être refusé. La charge doit être exacte. Il est important que le remplissage soit fait de manière homogène, c'est-à-dire qu'il ne devrait pas y avoir de bulles.
Une fois la caméra réglée au repos pendant 2 minutes pour que les cellules soient précipitées en arrière-plan et que sa visualisation et son comptage sont plus faciles.
Après le repos, le temps est monté sur la lumière du microscope optique pour l'observation. Il se concentre d'abord avec un objectif 10x et si nécessaire, il est passé à 40X.
Peut vous servir: Gap AnionPour améliorer votre visualisation, la lumière du microscope est réduite. Pour ce faire, le condenseur est abaissé et le diaphragme se ferme un peu.
Compte
Pour le récit des globules blancs ou des leucocytes, toute la surface des quatre carrés moyens des coins et le carré central de chaque réticulum doit être compté.
Le nombre commence sur le carré du coin supérieur gauche. Il commence du premier carré de la première rangée, c'est-à-dire de gauche à droite pour atteindre l'extrémité opposée.
Là, il est abaissé et le look est retourné de droite à gauche jusqu'à atteindre l'autre extrémité et ainsi de suite les cellules de chaque grille sous la forme de zigzag. Les 16 grilles de chaque carré moyen sont comptées.
Pour éviter de compter deux fois une cellule, il y a des règles sur les cellules situées sur les lignes limites de chaque grille. Les cellules situées dans les lignes gauche et supérieure sont comptées et celles qui sont situées sur les lignes droite et inférieure sont ignorées.
Un compteur de cellules manuel doit être disponible pour que l'opérateur opprime la clé de l'appareil autant de fois que l'observation des cellules. Avec l'utilisation du comptable, l'opérateur peut compter sans avoir besoin de rechercher le champ microscopique. À la fin du compte, vous observerez le nombre total de cellules comptées.
Calculs
Pour les calculs, vous pouvez procéder de plusieurs manières. Vous pouvez compter un seul réticulum ou les deux peuvent être comptés et une moyenne des deux. Dans ces deux situations, les cellules comptées doivent être multipliées par un facteur qui, dans ce cas, serait 40. Et donc le nombre total par mm est obtenu3.
Mais si les deux reticules sont comptés et qu'il n'y a pas de moyenne, il doit être multiplié par un facteur différent, dans ce cas par 20.
-Facteur de multiplication
Ensuite, le facteur de multiplication est calculé.
Pour les calculs, plusieurs données sont prises en considération, y compris le titre de dilution, la hauteur de la chambre et la surface racontées.
Dilution
La dilution utilisée de manière standard est de 1:20 pour le décompte des leucocytes.
Hauteur de chambre
La hauteur entre la caméra et la lame hématimétrique est de 0,1 mm.
Surface comptée
Si 5 carrés de 1 mm sont comptés2 Surface, cela signifie que le compte total du nombre est de 5 mm2. Ces données doivent être multipliées par la hauteur de la caméra pour obtenir le volume total indiqué. C'est-à-dire 5 mm2 x 0,1 mm = 0,5 mm3.
Formules et calculs
Avec les données qui sont dit, il est dit:
Si à 0,5 mm3 -il y a ° de cellules comptées
En 1 mm3 --il y aura - x nombre de cellules
X cellule n ° = (n ° des cellules calculé x 1) /0,5 mm3
Mais la dilution doit également être prise en compte. Par conséquent, la formule est la suivante:
(N ° des cellules comptées x 1) x 20 / 0,5 mm3
Enfin, pour résumer, vous pouvez multiplier le nombre de cellules comptées par 40. Ainsi, la valeur des leucocytes par mm est obtenue3.
Peut vous servir: osmose: processus, types, différences avec diffusion et exemplesDans le cas où les deux reticules sont comptés, les données de données sont modifiées que dans ce cas serait de 10 carrés, c'est-à-dire 10 mm2. Et un volume total raconté 1 mm3. La formule resterait:
(N ° des cellules comptées x 1) x 20/1 mm3
Par conséquent, dans ce cas, le facteur de multiplication serait de 20.
Erreurs
-Si lors du chargement de la caméra, il est dépassé ou dépassé avec du liquide, la hauteur de la caméra variera. Il en résulte le comptage du réel. Si vous essayez de retirer l'excès avec de la gaze ou du coton, cela représente une erreur de carafale. Cette action fera se concentrer les cellules, augmentant le décompte.
-S'il est mal facturé, le décompte sera sous le réel.
-Dans le cas où la caméra est montée et lâchée, il n'est plus possible de compter car il diffusera des résultats erronés.
-Si avant de charger la caméra, la dilution de l'échantillon n'est pas bien mélangée, il y a un risque d'erreur de lecture, car les cellules ne seront pas distribuées de manière homogène. Par conséquent, il y aura moins ou plus de concentration de cellules, selon que l'échantillon est prélevé de la surface du liquide ou du bas du tube.
-La présence de bulles diminue la quantité de liquide qui doit entrer dans le réticule, interférant avec la visualisation et la distribution correctes des cellules. Tout cela affecte considérablement les résultats.
-Pendant le décompte, ne soulevez pas le microscope jusqu'à ce que chaque grand carré soit terminé pour éviter de se perdre.
-Une raison d'erreur consiste à incliner la caméra après avoir monté. Par conséquent, vous devez télécharger soigneusement la plaque de microscope.
Recommandation
Si pour une raison quelconque, vous détectez une anomalie dans le dépôt de la caméra, il est le plus recommandé de démonter cette préparation, de nettoyer la caméra et de se rassembler à partir de zéro.
Soyez très prudent lors du nettoyage de la caméra pour éviter la rayure des réticules. D'un autre côté, gardez à l'esprit que le lamel hématimétrique est délicat et fragile. Une manipulation inadéquate peut la casser.
Avant de commencer à compter, assurez-vous que les cellules ont été bien distribuées. Une distribution inégale des cellules se produit par un mauvais mélange de l'échantillon ou de la dilution. Si cela se produit, l'assemblage doit être répété.
Une façon de savoir si les cellules sont bien distribuées comparent le compte de chaque grand carré, le nombre de cellules comptées par chaque carré ne doit pas être exagérément différent entre l'un et l'autre.
-Si la globules blanc comporte plus de 50.000 mm3 Il est conseillé de répéter le compte, faisant une plus grande dilution.
-S'il modifie la dilution, le facteur de multiplication doit calculer à nouveau, car cela influence la formule.
Les références
- Cardona-Maya W, Berdugo J, Cadavid A. Comparaison de la concentration de sperme à l'aide de la caméra de Makler et de la caméra de Neubauer. Urol ESP 2008; 32 (4): 443-445. Disponible sur: SCIELO.
- Caméra Neubauer. (2018, 27 mars). Wikipedia, encyclopédie gratuite. Date de consultation: 04:10, 23 juin 2019 de ES.Wikipédia.org
- Meneses A, Rojas L, Sifontes S. Application d'une méthode de comptage alternative dans la chambre de Neubauer pour déterminer la concentration de Vaginalis trichomonas. Tour. Cub Med Trop 2001; 53 (3): 180-8. Disponible sur: ResearchGate.filet
- Gómez-perez roald e. Analyse de l'expermogramme. Tour. Venez. Endocrinol. Métab. 2007; 5 (2): 19-20. Disponible sur: ve.SciElo
- Guide de l'hématologie pratique de l'école de bioanalyse de l'Université de Carabobo. Venezuela.1998
- « Aspects positifs ou négatifs présents dans la démocratisation des connaissances
- Aspect le plus important de la petite science, de la grande science et de la technologie »

