Structure du chlorure de fer (III), propriétés, obtention, utilisations
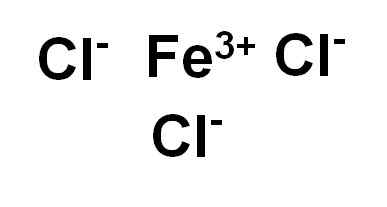
- 4502
- 1133
- Prof Noah Collet
Il chlorure de fer (III) C'est un composé inorganique formé par le fer (foi) et les éléments du chlore (CL). Sa formule chimique est fecl3. C'est un solide cristallin dont la couleur peut être de l'orange au brun noirâtre.
Le fecl3 Il est facilement dissous dans l'eau formant des solutions aqueuses acides dans lesquelles en augmentant le pH, les rendant plus alcalines.
 Chlorure de fer (iii) ou chlorure ferrique fecl3 solide. Еор осин / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons.
Chlorure de fer (iii) ou chlorure ferrique fecl3 solide. Еор осин / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0). Source: Wikimedia Commons. Le chlorure de fer (III) est utilisé pour sédimenter les particules qui polluent les eaux usées municipales ou industrielles. On dit qu'il vous permet d'éliminer certains parasites et de servir à arrêter les pertes de sang des animaux chez les animaux et pour la guérison de ces.
Il sert à extraire le cuivre (II) des minéraux sulfurices en cuivre. Il est également utilisé dans diverses réactions chimiques et analyse des laboratoires biologiques et chimiques. Par exemple, il sert à détecter les composés sous forme de phénols dans les huiles extraites des plantes. Il est utilisé dans les circuits électroniques, dans le tanneur en cuir et en photographie.
Pour être le fecl3 Un composé acide est corrosif pour la peau et les muqueuses. La poussière de ce composé doit être évité. Il ne doit pas être jeté dans l'environnement.
[TOC]
Structure
Chlorure de fer (iii) ou chlorure ferrique fecl3 C'est un composé ionique et est formé par une foi ferrique3+ et trois ions chlorure cl-. Le fer est dans son état d'oxydation de +3 et chaque chlore a Valencia -1.
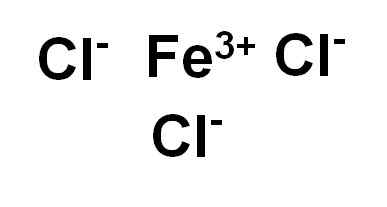 Chlorure de fer (iii) ou chlorure ferrique. Auteur: Marilú Stea.
Chlorure de fer (iii) ou chlorure ferrique. Auteur: Marilú Stea. Nomenclature
- Chlorure de fer (III)
- Chlorure ferrique
- Trichlorure de fer
- Murialisation en fer
Propriétés
État physique
Orange massif cristallin à brun noirâtre.
 Chlorure ferrique fecl3 anhydre (sans eau). Leiem / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Chlorure ferrique fecl3 anhydre (sans eau). Leiem / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Poids moléculaire
Anhidro fecl3 = 162,2 g / mol
Point de fusion
Anhidro fecl3 = 304 ºC
Hexahydrate fecl3 •6h2O = 37 ° C
Point d'ébullition
Anhidro fecl3 = Environ 316 ºC
Hexahydrate fecl3 •6h2O = 280-285 ° C
Densité
Anhidro fecl3 = 2,90 g / cm3 à 25 ° C
Solubilité
Très soluble dans l'eau: 74,4 g / 100 g d'eau à 0 ° C; 535,7 g / 100 g d'eau à 100 ° C. Très soluble dans l'acétone, l'éthanol, l'éther et le méthanol. Faiblement soluble dans des solvants non polaires comme le benzène et l'hexane.
Peut vous servir: bore: historique, propriétés, structure, utilisationspH
Ses solutions aqueuses sont très acides. Une solution de 0,1 moles de FECL3 par litre d'eau a un pH de 2,0.
Propriétés chimiques
Quand le fadl se dissout dans l'eau3 Il est hydrolysé; c'est-à-dire qu'il se sépare dans ses ions de foi3+ et 3 CL-. Foi3+ former l'ion hexaacuohierro [foi (h2SOIT)6]]3+ Mais cela est combiné avec des ions OH- de l'eau formant des espèces mixtes et libérant des protons h+.
Pour cette raison, leurs solutions sont acides. Si le pH augmente, ces espèces forment un gel et enfin un précipité ou un solide de foi d'oxyde ferrique hydraté se forment2SOIT3 •NH2SOIT.
Les cristaux de chlorure de fer (III) sont hygroscopiques, c'est-à-dire qu'ils absorbent l'eau de l'environnement. Quand il est humide, il est corrosif pour l'aluminium et de nombreux métaux.
 Solutions FECL3 Ils peuvent être très acides et corrosifs, car ils contiennent du HCl. Kanesskong / cc by-sa (https: // createCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons.
Solutions FECL3 Ils peuvent être très acides et corrosifs, car ils contiennent du HCl. Kanesskong / cc by-sa (https: // createCommons.Org / licences / by-sa / 4.0). Source: Wikimedia Commons. Solutions aqueuses fecl3 Ils sont très acides et corrosifs pour la plupart des métaux. Ils ont une odeur faible d'acide chlorhydrique HCL. Lorsque le FECL est chauffé jusqu'à sa décomposition3 émet des gaz HCL hautement toxiques.
Obtention
Le chlorure de fer (III) est produit par chloration directe du fer en réagissant au chlore sec (Cl2) Avec un fer à fer (foi) à 500-700 ° C.
La réaction est réalisée dans un réacteur résistant à l'acide. La première étape consiste à fondre à 600 ° C un mélange de chlorure de fer (III) (FECL3) et le chlorure de potassium (KCL).
 Le fecl3 Il doit être préparé dans des conteneurs très résistants aux acides tels que l'acier inoxydable. Auteur: Johannes Plenio. Source: Pixabay.
Le fecl3 Il doit être préparé dans des conteneurs très résistants aux acides tels que l'acier inoxydable. Auteur: Johannes Plenio. Source: Pixabay. Ensuite, le fer à fer (foi) est dissous dans ce mélange fondu où le fer réagit avec le fecl3 Et il devient du chlorure ferreux (FECL2).
FE + 2 FECL3 → 3 FECL2
Puis le fecl2 réagit avec le chlore cl2 Former la FECL3 qui sublimate (passe de l'état solide vers le gazeux directement) et est collecté dans des chambres de condensation spéciales.
2 fecl2 + CL2 → 2 FECL3
Vous pouvez également réagir le sulfate de feso ferreux4 avec du chlore cl2.
Hexahydrate fecl3 •6h2O Il peut être obtenu en évaporant une solution aqueuse d'ions foi3+ et cl- Dans un bain de vapeur.
Peut vous servir: Composés quaternaires: caractéristiques, formation, exemplesPrésence dans la nature
Le chlorure ferrique ou le chlorure de fer (III) se trouve sous la forme sous la forme du mi-minéral, qui se trouve dans la lave des fumaroles du volcan actif. Parmi les volcans où vous pouvez trouver est le mont Vesubio.
 Le fecl3 Il fait partie du minerai Moysite qui est dans des volcans actifs. Auteur: Skeze. Source: Pixabay.
Le fecl3 Il fait partie du minerai Moysite qui est dans des volcans actifs. Auteur: Skeze. Source: Pixabay. Applications
Dans le traitement des eaux usées
Le chlorure ferrique est utilisé pour traiter les eaux usées municipales ou industrielles par sédimentation chimique.
Il agit comme un coagulant favorisant l'union de plusieurs particules les uns avec les autres, de cette manière, des conglomérats ou des particules plus grandes se forment qui ont tendance à être floculaire ou sédimentaire (abaissant leur propre poids au fond de l'eau qui est traité).
 Le fecl3 Il est utilisé pour séparer les matériaux indésirables des eaux jetées par les communautés ou les industries. Auteur: 后园 卓. Source: Pixabay.
Le fecl3 Il est utilisé pour séparer les matériaux indésirables des eaux jetées par les communautés ou les industries. Auteur: 后园 卓. Source: Pixabay. De cette façon, la séparation des solides d'eau est favorisée et cela est exempt de matériaux indésirables.
Ce type de traitements peut faciliter l'élimination des parasites, tels que les protozoaires, qui sont des micro-organismes formés par une seule cellule, comme les amibas, qui provoquent une maladie.
Pour cette raison3 Il est également utilisé pour purifier l'eau.
Dans les procédures de guérison vétérinaire
Le chlorure de fer (III) est utilisé pour guérir les blessures animales.
Il sert d'astringent local (vous pouvez retirer les tissus et agir comme anti-inflammatoire et guérison) et hémostatique (il arrête les saignements ou les pertes de sang).
Il est utilisé dans les poudres pour arrêter les pertes de sang ou lorsque les chevaux ont été coupés au bétail. Il est également utilisé dans une solution pour arrêter les saignements lorsque les griffes sont coupées ou que les verrues sont éliminées.
 Le fecl3 Il est utilisé dans les poudres appliquées aux cornes coupées des vaches et éviter les infections. Auteur: Jaclou DL. Source: Pixabay.
Le fecl3 Il est utilisé dans les poudres appliquées aux cornes coupées des vaches et éviter les infections. Auteur: Jaclou DL. Source: Pixabay. Il est également utilisé pour traiter la pharyngite (inflammation du pharynx) ou la stomatite (inflammation de la muqueuse buccale) et pour augmenter l'hémoglobine sanguine chez certains oiseaux.
Dans l'extraction des métaux
Chlorure de fer (iii) ou chlorure ferrique fecl3 Il est utilisé pour extraire le cuivre (II) de minerai de cuivre contenant des sulfures de ce métal.
Peut vous servir: hydroxydesIl s'agit d'une méthode oxydative qui est suffisante pour éviter la libération de dioxyde de soufre de gaz toxique (donc2), car au lieu de cela est généré de soufre (s). Des solutions à fortes concentrations de FECL sont produites2, Fecl3, Cucl2 et autres chlorures métalliques.
4 FECL3 + Cu2S ⇔ 4 FECL2 + 2 CUCL2 + S ↓
En tant que réactif des laboratoires chimiques et biologiques
Parmi plusieurs de ses utilisations de chimie, des services pour indiquer la présence du groupe phénolique (c'est-à-dire le groupe -OH attaché à un anneau de benzène).
Le composé est dissous pour être analysé dans l'éthanol et quelques gouttes de solution FECL sont ajoutées3. Lorsque le composé a un groupe -OH attaché à un anneau de benzène (c'est-à-dire, c'est un phénol), une coloration verte bleuâtre se forme.
Ce test permet d'analyser la présence de phénols dans des extraits de plantes.
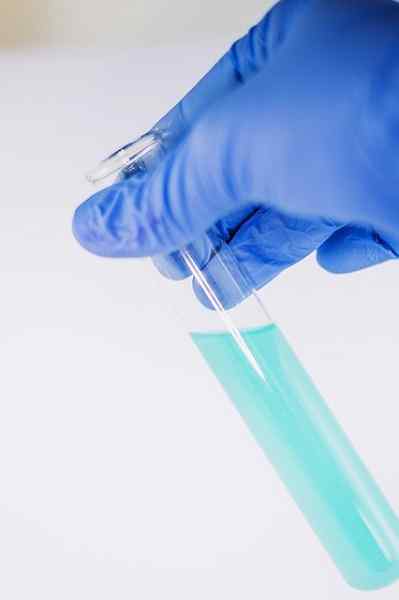 Le fecl3 En présence de phénols, il donne une coloration verte bleuâtre. Auteur: Ewa Urban. Source: Pixabay.
Le fecl3 En présence de phénols, il donne une coloration verte bleuâtre. Auteur: Ewa Urban. Source: Pixabay. Il est également utilisé dans les tests pour déterminer l'activité antioxydante de certaines huiles extraites des légumes.
Une autre de ses applications est qu'elle permet de préparer d'autres composés chimiques. Il peut également agir comme un agent oxydant et de chloration (fournir du chlore) et un condenseur (pour rejoindre deux ou plusieurs molécules les uns avec les autres).
Il sert également de catalyseur ou d'accélérateur de réactions de chimie organique.
Dans plusieurs applications
Le chlorure ferrique est utilisé dans les circuits électroniques imprimés. Par la coloration de ses différentes formes hydratées, il sert de pigment et est utilisé dans le tanneur en cuir.
 Le fecl3 Il est utilisé dans le bronzage en cuir. Auteur: Pexels. Source: Pixabay.
Le fecl3 Il est utilisé dans le bronzage en cuir. Auteur: Pexels. Source: Pixabay. C'est désinfectant. Il est utilisé pour traiter les troubles cutanés et est également utilisé en photographie.
Des risques
Poudre de fecl3 Il est irritant pour les yeux, le nez et la bouche. Si l'inhale peut provoquer une toux ou une difficulté à respirer. C'est un composé corrosif, donc un contact prolongé avec la peau et avec les yeux ou les muqueuses peut provoquer des rougeurs et des brûlures.
Il n'est pas inflammable, mais lorsqu'il est chauffé à des températures élevées, il produit du chlorure d'hydrogène HCl, qui est toxique et très corrosif.
Le fecl3 Il est nocif pour les organismes aquatiques et terrestres. Si par accident, il est jeté à l'environnement, son acidité avec les composés de base doit être neutralisée.
Les références
- OU.S. Bibliothèque nationale de médecine. (2019). Chlorure ferrique. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Kirk-othmer (1994). Encyclopédie de la technologie chimique. Volume 19. Quatrième édition. John Wiley & Sons.
- Encyclopédie de la chimie industrielle d'Ullmann. (1990). CINQUIÈME ÉDITION. Volume A22. VCH VERLAGSGELLSCHAFT MBH.
- Ngameni, b. et al. (2013). Flavonoïdes et composés connexes des plantes médicinales d'Afrique. Caractérisation des flavonoïdes dans les extraits de plantes. Test de chlorure ferrique. Dans la recherche sur les plantes médicinales en Afrique. Récupéré de ScienceDirect.com.
- Agyare, C. et al. (2017). Petroselinum Crispum: une revue. Activité antioxydante. Dans des spartes et légumes médicinaux d'Afrique. Récupéré de ScienceDirect.com.
- Stott, R. (2003). Fate et comportement des parasites dans les systèmes de traitement des eaux usées. Sédimentation assistée chimiquement. Dans Handbook of Water and Wastewater Microbiology. Récupéré de ScienceDirect.com.
- Tasker, P.POUR. et al. (2003). Applications de la chimie de la coordination. Extraction de CuIi Des solutions de chlorure. Dans la compréhension de la chimie de la coordination. Récupéré de ScienceDirect.com.
- Coton, F. Albert et Wilkinson, Geoffrey. (1980). Chimie inorganique avancée. Quatrième édition. John Wiley & Sons.
- « +125 dictons courts et populaires [avec sens]
- 95 paroles et ont dit les Vénézuéliens et leur signification »

