Caractéristiques, développement et fonction du cytotrophoblaste
- 4247
- 557
- Louna Baron
Il cytotrophoblaste O cellules Langhans, c'est la partie de la membrane basale du trophoblaste composé de cellules mononucléées. Cette partie correspond à la population de cellules souches, à partir desquelles les autres trophoblastes dérivent.
Cette couche cellulaire du point de vue mitotique est très active, produisant des cellules qui se lient au syncytiotrophoblaste. Le cytotrophoblaste provient de la période d'implantation du blastocyste dans le développement embryonnaire des mammifères. Au cours de cette phase de développement, les cellules trophoblastiques prolifèrent céder la place à l'invasion de l'épithélium endométrial.
 Source: Henry Vandyke Carter [Domaine public]
Source: Henry Vandyke Carter [Domaine public] [TOC]
Caractéristiques
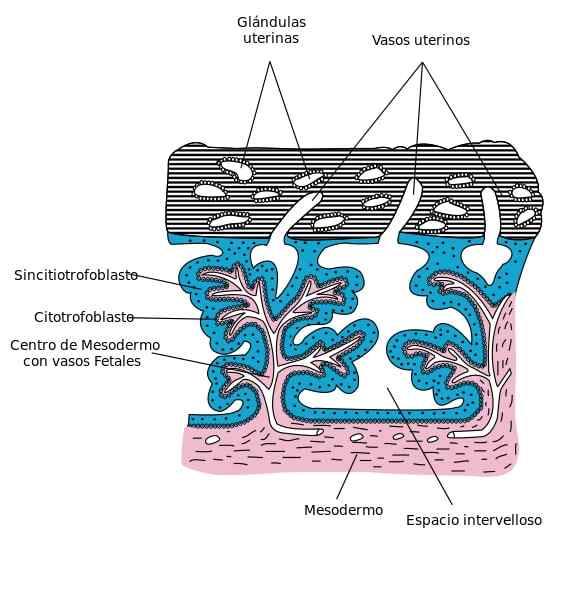
Une couche de cellules mononucléées constitue le cytotrophoblaste, sur le côté interne du trophoblaste. Ces cellules sont situées dans les villos. Le cytotrophoblaste est caractérisé par une différenciation et une capacité de prolifération des cellules élevées et une faible activité fonctionnelle.
Pendant la phase ou la fenêtre de l'implantation de l'embryon, les cellules cytotrophoblastes proviennent, devenant cubes et pâles d'une bonne image nucléaire, et bien différenciés les uns des autres.
La prolifération des cellules cytotrophoblastiques se produit par multiplicité continue. On estime qu'au moins la moitié des cellules de cette couche effectuent un cycle cellulaire. En plus de la prolifération, il existe une différenciation cellulaire élevée qui génère le syncytiotrophoblaste.
Extravelllopostarian Cytophoblast
L'extravail cytophoblaste est situé à l'extérieur sur les villosités chorioniques. Cette couche cellulaire prolifère rapidement en envahissant le stroma utérin et les artères spirales de l'endomètre, réduisant la résistance des murs vasculaires. Deux types de cytophoblastes extravellorétaires sont différenciés: l'interstitiel et l'endovasculaire.
Dans l'interstitiel, les cellules envahissent le myomètre à fusionner et à devenir de grandes cellules placentaires. Ces cellules n'envahissent pas les murs vasculaires.
Peut vous servir: PachyneL'envasculaire en revanche, envahit les parois vasculaires détruisant les cellules lisses de la couche intermédiaire du vaisseau sanguin, ayant un matériau fibrinoïde à la place. La diffusion des molécules qui simulent un phénotype endothélial permet de remplacer l'endothélium des vaisseaux sanguins maternels par une nouvelle surface interne.
L'activité cytotrophoblaste est régulée par des facteurs génétiques, transcription, croissance, hormonaux et chimiques (tels que la concentration en oxygène moléculaire).
Développement et fonction
Chez les mammifères, après la fécondation de l'ovule par un sperme, une série de divisions cellulaires est effectuée jusqu'à ce que le blastocyste se forme, qui est une sphère cellulaire creuse où la couche cellulaire périphérique donne naissance au trophoblaste, tandis que l'amas de cellules internes provient les tissus embryonnaires, appelant des embryoblastes.
Blastocyste est fixé à l'endomètre pendant la mise en œuvre. Les cellules trophoblastiques commencent à se propager lorsqu'ils entrent en contact avec l'endomètre, différenciant ainsi le cytotrophoblaste et le syncytiotrophoblaste.
Dans les espèces humaines, la mise en œuvre se produit approximativement au sixième jour après l'ovulation et la fertilisation de l'ovule.
Chez certains mammifères, cette phase est reportée pendant des jours, des semaines, voire des mois, afin d'éviter l'arrivée d'une nouvelle race à un moment non abrégé, comme dans les périodes où les ressources diminuent ou pendant que la mère allaite une autre reproduction.
Chez les animaux tels que les ours, les testaments, les sceaux et les chameaux, un retard de la fenêtre d'implantation connue sous le nom de diapause embryonnaire se produit.
Le blastocyste reste dans cet état, sans prolifération des cellules cytotrophoblastiques, par action hormonale. Ce mécanisme est déclenché en réponse à des facteurs environnementaux ou à l'allaitement prolongé chez la mère.
Peut vous servir: que sont chromoplastes?Formation de placenta
Le placenta est responsable du maintien du fœtus en développement et dérive du chorion (partie fœtale) et de l'absociation basale. Dans ce document, des échanges de gaz et de métabolites entre les circulations maternelles et fœtales se produisent. Cet organe se développe à l'origine de villosités différenciables.
Lorsque les cellules cytotrophoblastiques et avec le développement du mésentère chorionique et des vaisseaux sanguins se développent, les villosités choriales primaires, secondaires et tertiaires sont formées.
Le cytotrophoblaste prolifère rapidement, passant ses cellules dans des lagunes sanguines à l'intérieur du synciotrophoblaste, formant des villosités choriales primaires.
Par la suite, ces villos.
Les villosités tertiaires sont formées avec l'apparition de vaisseaux sanguins dans le mésenchyme des villosités secondaires.
Tandis que les villosités tertiaires, des fils ou des cellules cupcates de cytotrophoblaste sont formées à l'extérieur par le synciotroplaste.
De cette façon, diverses agglomérats cellulaires vont à l'étranger et se réunissent, couvrant la synciotrophoblaste avec une couverture cytotrophoblastique. Cette couverture est interrompue là où les vaisseaux sanguins maternels se rendent dans les espaces inter-velllositaires.
Interface maternelle-fœtale
La première étape de l'interface maternelle-fœtale se compose de l'invasion du cytophoblaste extravellorétaire (situé à l'extérieur des villos. De cette façon, la perfusion adéquate de la croissance fœtale est maintenue.
Dans la deuxième phase, les cellules cytotrophoblastes se combinent, annulant leurs membranes cellulaires, pour donner naissance à la couche multinucléée du synciotrophoblaste. Ce dernier enveloppe les villosités différenciées du placenta.
Peut vous servir: Hepar Will Sulfate: fonctions, synthèse, relation avec les maladiesLe développement approprié de ces deux étapes de l'interface, assurent la pacentation correcte et donc un développement fœtal réussi et un progrès sûr de l'état de gravité.
La barrière placentaire sépare le sang maternel et fœtal
Une barrière placentaire, essentiellement formée par les couches de tissu fœtal, est responsable de la séparation du sang du fœtus du sang maternel. Chez l'homme, depuis le quatrième mois de développement, cette barrière devient très mince, facilitant le transfert de produits à travers elle.
La dégénérescence de la coquille ou de la couverture cytotrophoblastique est la cause de la perte de poids de la barrière placentaire, dans l'état dégénéré duquel il est composé de syncitiotrophoplaste, de couverture discontinu cytotrophoblastique, de tron basal et de feuille d'endothélium, de velurité, de l'extrémité basale de l'endothélium et de l'endothélium de capillaires placentaires fœtaux de villages tertiaires.
La barrière placentaire, en plus de séparer le sang de la mère et du sang fœtal, est responsable de l'échange d'oxygène et du dioxyde de carbone et des métabolites entre les circulations maternelles et fœtales.
Les références
- Hernández-Valencial, m., Valence-Ortega, J., Ríos-Castillo, B., Cruz-Cruz, P. D. R., & Vélez-Sánchez, D. (2014). Éléments d'implantation et de placentation: aspects cliniques et méléculaires. Magazine de médecine de reproduction mexicaine, 6 (2), 102-16.
- Colline, r. W., Wyse, g. POUR., Anderson, M., & Anderson, M. (2004). Animal de physiologie (Vol. 2). Sunderland, MA: Sinauer Associates.
- Kardong, k. V. (Année mille neuf cents quatre-vingts-quinze). Vertébrés: anatomie comparative, fonction, évolution. Élégant. McGraw Hill.
- Rodríguez, M., Couve, c., Egaña, g., & Chamy, V. (2011). Apoptose placentaire: mécanismes moléculaires dans la genèse de la préclampsie. Magazine chilien de l'obstétrique et de la gynécologie, 76 (6), 431-438.
- Ross, M. H., & Pawlina, W. (2007). Histologie. Élégant. Pan -American Medical.
- Welsch, u., & Sobotta, J. (2008). Histologie. Élégant. Pan -American Medical.
- « Caractéristiques de synciotrophoplastes, fonction, apoptose placentaire
- Caractéristiques des basophiles, morphologie, fonctions, maladies »

