Structure de la cytosine, fonctions, propriétés, synthèse
- 2936
- 511
- Prof Noah Collet
La Cytosine Il s'agit d'une base d'azote pyrimidine, qui sert à la biosynthèse de la cytidine-5'-monophosphate et de la déxicitidine-5'-monophosphate. Ces composés servent respectivement de la biosynthèse de l'acide désoxyribonucléique (ADN) et de l'acide ribonucléique (ARN). L'ADN stocke les informations génétiques et l'ARN a diverses fonctions.
Chez les êtres vivants, la cytosine ne se trouve pas librement, mais généralement des ribonucléotides ou des désoxyribonucléotides. Les deux types de composés ont un groupe phosphate, un ribose et une base d'azote.
 Source: VESPRCOM [Domaine public]
Source: VESPRCOM [Domaine public] Le carbone 2 du ribose a un groupe oxhydrillo (-OH) dans les ribonucléotides et un atome d'hydrogène (-H) dans les désoxyribonucléotides. Selon le nombre de groupes de phosphate présents, il y a Citidín-5'-monophosphate (CMP), Citidín-5'-diphosphate (CDP) et Citidín-5'-triffosphate (CTP) (CTP).
Les équivalents désoxygénés sont appelés desoxicididine-5'-monophosphate (DCMP), la desoxicididine-5'-diphosphate (DCDP) et la désoxicididine-5'-triffosphate (DCTP).
La cytosine, dans ses différentes formes, participe à différentes fonctions, telles que la biosynthèse de l'ADN et de l'ARN, la biosynthèse des glycoprotéines et la régulation de l'expression du gène.
[TOC]
Structure et propriétés
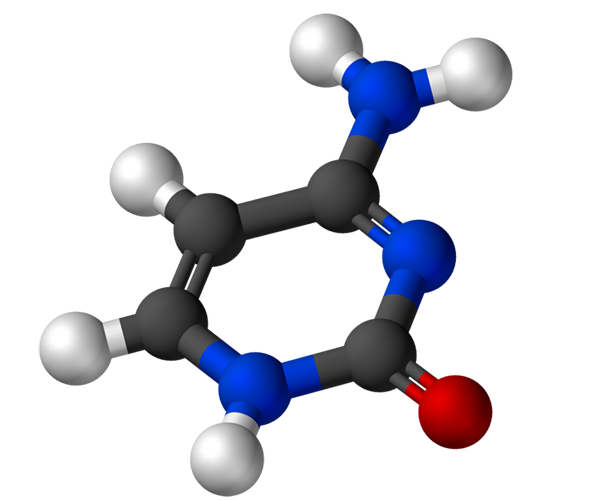
La cytosine, 4-amino-2-hydroxipirimidine, a la formule empirique C4H5N3Ou, dont le poids moléculaire est de 111,10 g / mol et est purifié en poudre blanche.
La structure de la cytosine est un anneau hétérocyclique, aromatique et planaire. La longueur d'onde d'absorbance maximale (ʎMax) C'est 260 nm. La température de fusion de la cytosine dépasse 300 ºC.
Pour former un nucléotide, la cytosine se lie de manière covalente, à travers l'azote 1, par des moyens. Le carbone 5 'est estérifié avec un groupe de phosphate.
Biosynthèse
La biosynthèse nucléotidique pyrimidine a une voie commune, qui se compose de six étapes catalysées par les enzymes. La route commence par la biosynthèse du carbamoil-phosphate. Dans les procaryotes, il n'y a qu'une seule enzyme: carbamoil phosphate synthase. Ceci est responsable de la synthèse des pyrimidines et de la glutamine. Dans les eucaryotes, il existe des carbamoil phosphate synthase I et II, qui sont respectivement responsables de la biosynthèse de la glutamine et de la pyrimidine.
La deuxième étape consiste en la formation de N-carbamoilaspartato, du phosphate de glucides et de l'aspartate, réaction catalysée par le transpartate transcabamoilasa (atcasa)).
La troisième étape est la synthèse du l-dihydrotoate, qui produit la fermeture de l'anneau de pyrimidine. Cette étape est catalysée par la dihydrootase.
La quatrième étape est la formation d'orotato, qui est une réaction redox catalysée par la dihydroorotate déshydrogénase.
La cinquième étape consiste en la formation de Golylate (OMP) en utilisant du phosphoribosyl pyrophosphate (PRPP) comme substrat, et la phosphoribosyl orotate transférase comme catalyseur comme catalyseur.
La sixième étape est la formation d'uridilaato (uridine-5'-monophosphate, UMP), réaction catalysée par une omp-décarboxylase.
Il peut vous servir: flore et faune de HidalgoLes étapes suivantes sont constituées de la phosphorylation de l'UMP, catalysée par des kinases, pour former l'UTP, et le transfert d'un groupe amino de la glutamine à l'UTP pour former CTP, réaction catalysée par CTP synthétase.
Régulation de la biosynthèse
Chez les mammifères, la régulation se déroule à la phosphate synthase carbamoil.
Carbamoil Syntasa II est régulé par une rétroaction négative. Ses régulateurs, l'UTP et le PRPP, sont, respectivement, inhibiteurs et activateurs de cette enzyme.
Dans les tissus qui ne sont pas hépatiques, Carbamoil Phosphate synthase II est la seule source de phosphate de carbamoil. Pendant que dans le foie, dans des conditions d'excès d'ammoniac, le carbamoil phosphate synthase I produit, dans les mitochondries, le phosphate de carbamoil, qui est transporté vers le cytosol, d'où il entre dans le chemin de la biosynthèse des pyrimidines.
Un autre point de régulation est l'OMM-Discarboxylase, qui est régulée par une inhibition concurrentielle. Le produit de sa réaction, UMP, rivalise avec l'OMP pour le site de liaison dans l'Omp-DeScarboxilasa.
Les pyrimidines, comme la cytosine, sont recyclées
Le recyclage des pyrimidines a en fonction la réutilisation des pyrimidines sans avoir besoin de biosynthèse novo et éviter le chemin de dégradation. La réaction de recyclage est catalysée par la phosphoribosyltransférase pyrimimidine. La réaction générale est la suivante:
Pyrimidine + prpp -> nucléoside pyrimidine 5 '-monophosphate + ppi
Chez les vertébrés, la phosphoribosyltransférase pyrimimidine se trouve dans les érythrocytes. Le substrat de pyrimidines de cette enzyme est l'uracile, le timina et l'orotato. La cytosine est indirectement recyclée à partir de l'uridine-5'-monophosphate.
Fonction dans la biosynthèse de l'ADN
Pendant la réplication de l'ADN, les informations contenues dans l'ADN sont copiées dans l'ADN par une ADN polymérase.
La biosynthèse de l'ARN nécessite des désoxynucléotides tryphosphate (DNTP), à savoir: le dexitimid tryphosphate (DTTP), le triffosphate de dixicitidy (DCTP), la de -alxyxyadénine tryphyse (DATP) et la dexiguanine Tryphosphate (DGTP)). La réaction est:
(ADN)n déchets + Dntp -> (ADN)N + 1 déchets + PPI
L'hydrolyse du pyrophosphate inorganique (PPI) fournit de l'énergie pour la biosynthèse de l'ARN.
Fonction dans la stabilisation de la structure de l'ADN
Dans la double hélice DNUS, une purine, d'une chaîne, est liée à la pyrimidine, de la chaîne opposée, par des liaisons hydrogène. Ainsi, la cytosine est toujours liée à la guanine par trois liaisons hydrogène: l'adénine est liée à Timin par deux liaisons hydrogène.
Cela peut vous servir: importance de la biologieLes liaisons hydrogène sont brisées lorsqu'une solution d'ADN native purifiée à pH 7, est soumise à des températures supérieures à 80 ºC. Cela fait former l'hélice ADN double deux chaînes distinctes. Ce processus est connu sous le nom de dénaturation.
La température à laquelle 50% de l'ADN est dénaturé est connue sous le nom de température de fusion (TM). Molécules d'ADN dont la guanine et la cytosine.
Ce qui précède est le test expérimental qu'un plus grand nombre de liaisons hydrogène stabilise mieux les molécules d'ADN natives.
Fonction des régions riches en cytosine dans l'ADN
Récemment, il a été constaté que l'ADN du noyau cellulaire humain peut adopter des structures de motifs intercalés (IM). Ces structures sont produites dans les régions de cytosine.
La structure IM se compose de quatre chaînes d'ADN, contrairement à l'ADN classique à double hélice qui a deux chaînes. Plus précisément, deux chaînes en duplex parallèle sont entrecoupées dans une orientation antiparallela et sont maintenues ensemble par une paire de cytosines hémiprotonées (C: C: C+).
Dans le génome humain, les structures IM se trouvent dans des régions telles que les promoteurs et les télomères. Le nombre de structures IM est plus élevé pendant la phase G1 / S du cycle cellulaire, dans lequel la transcription est élevée. Ces régions sont des sites de reconnaissance des protéines impliqués dans l'activation des machines transcriptionnelles.
D'un autre côté, dans les régions riches en bases de guanine (c) consécutives, l'ADN a tendance à adopter la forme d'hélice A, dans des conditions de déshydratation. Cette forme est typique de l'ARN et des bandes mixtes à double ADN-Arn pendant la transcription et la réplication, et à certains moments où l'ADN est lié aux protéines.
Il a été démontré que les régions avec des bases de cytosine consécutives créent un patch électropositif dans la fente principale de l'ADN. Par conséquent, on pense que ces régions se lient aux protéines, qui prédisposent certaines régions génomiques de la fragilité génétique.
Fonction dans la biosynthèse de l'ARN
Pendant la transcription, les informations contenues dans l'ADN sont copiées dans l'ARN via un ARN PON polymérase. La biosynthèse de l'ARN nécessite des nucléosides de tryposphate (NTP), à savoir: Tryphyse Citidine (CTP), Tryposphate uridine (UTP), adénine tryposphate (ATP) et tryphosphate guanine (GTP). La réaction est:
Peut vous servir: flore et faune de Campeche: espèces représentatives(ARN)n déchets + NTP -> (ARN)N + 1 déchets + PPI
L'hydrolyse du pyrophosphate inorganique (PPI) fournit de l'énergie pour la biosynthèse de l'ARN.
Fonction dans la biosynthèse des glycoprotéines
Le transfert séquentiel d'hexoses pour former les oligosaccharides, O-ligates en protéines, se produit à partir de précurseurs nucléotidiques.
Chez les vertébrés, la dernière étape de la biosynthèse des oligosaccharides ligaturées O consiste en l'ajout de deux déchets d'acide sinal (N-acétylneuramine) à partir d'un précurseur de la Citidine-5'-monophosphate (CMP). Cette réaction est produite dans le sac trans de Golgi.
Traitements de cytosine et de chimiothérapie contre le cancer
La tétrahydropholate acide (FH4) est une source de groupe -ch3, Et il est nécessaire pour la biosynthèse DTMP de Dump. FH2 est également formé. La réduction de FH2 à FH4 nécessite un folate et une nadph réductase. Certains inhibiteurs de folate réductase, tels que l'aminoptérine et le métretothrexate, sont utilisés dans les traitements contre le cancer.
Metotrexan est un inhibiteur compétitif. La folate réductase se joint à 100 fois plus d'affinité avec cet inhibiteur qu'à son substrat. L'aminaptérine agit de la même manière.
L'inhibition de la folate réductase entrave indirectement la biosynthèse du DTMP, et donc celle de DCTP. L'inhibition directe se produit à travers les inhibiteurs de la synthétase timidilate, qui catalyse le DTMP à partir du dépotoir. Ces inhibiteurs sont 5-fluorouracile et la 5-fluoro-2-dioxiuridine.
Par exemple, le 5-fluoroacil n'est pas un inhibiteur mais devient d'abord, l'itinéraire de recyclage, dans le mofosphate de désoxyuride D (FDUmp), qui se lie à la synthésase timidilate et l'inhibe.
Substances analogues à la glutamine, à l'azasérine et à l'acivicine, inhibent l'amidotransférase glutamine. L'azarine a été l'une des premières substances découvertes qui agissent comme une inactivation suicidaire.
Les références
- Assi, H.POUR., Garavís, m., González, C., Et damha, m.J. 2018. ADN i-motif: caractéristiques structurelles et signification à la biologie cellulaire. Nuclei Acids Research, 46: 8038-8056.
- Bohinski, R. 1991. Biochimie. Addison-Wesley Iberoamericana, Wilmington, Delaware.
- Devlin, t.M. 2000. Biochimie. Reverté éditorial, Barcelone.
- Lodish, H., Berk, un., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Biologie cellulaire et moléculaire. Éditorial Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexique, Sāo Paulo.
- Nelson, D. L., Cox, M. M. 2008. Lehninger-primeciples de biochimie. W.H. Freeman, New York.
- Voet, D. Et Voet, J. 2004. Biochimie. John Wiley and Sons, USA.
- « Budget de revenu pour ce qui est l'utilisation et les exemples
- Structure cardiolipine, synthèse, fonctions »

