Enzyme cinétique
- 2521
- 101
- Prof Ines Gaillard
Qu'est-ce que la cinétique enzymatique?
La Enzyme cinétique Il s'agit d'un domaine d'étude dans lequel la physicochimie et la biochimie se réunissent pour étudier les réactions chimiques catalysées par les enzymes. Les enzymes sont des catalyseurs biologiques qui augmentent la vitesse d'une réaction chimique en diminuant leur énergie d'activation.
Les enzymes catalysent les réactions chimiques d'une grande importance pour le maintien de la vie. Ils ont à la fois un pH et une température optimale pour exercer leur action catalytique sur le substrat, ce sont donc des facteurs essentiels dans l'étude de leurs activités.
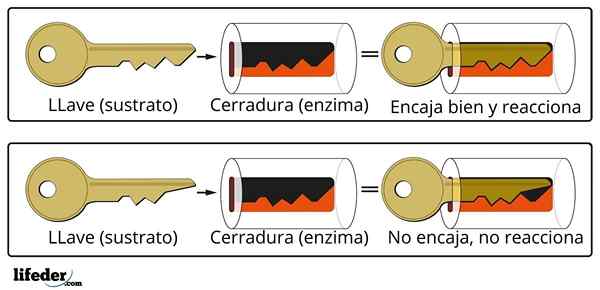
 Le système de fermeture des clés est une analogie approximative avec le système de substrat-enzyme.
Le système de fermeture des clés est une analogie approximative avec le système de substrat-enzyme. L'enzyme interagit avec le substrat à travers une région spécialisée de sa chaîne de protéines, qui est appelée centre actif, dont la structure à trois dimensions est couplée à la structure du substrat. L'interaction entre le centre actif et le substrat est généralement faible et non covalente.
Le nombre de centres enzymatiques actifs est limité, produisant sa saturation avec des molécules de substrat, ce qui empêche à son tour la vitesse de la réaction d'augmenter au-delà d'une certaine valeur, connue sous le nom de vitesse maximale.
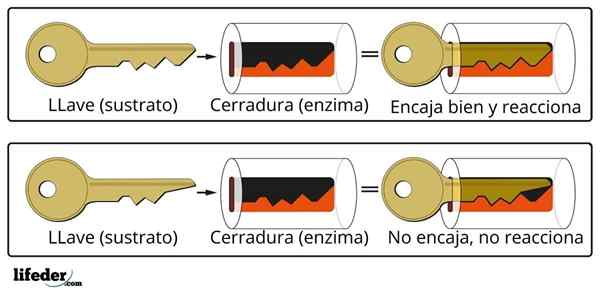
La cinétique enzymatique combine non seulement la biochimie et la physicochimie, mais aussi la bioinorganique, la chimie supramoléculaire, la chimie informatique et les statistiques.
Parmi les modèles qui le décrivent, c'est celui de Michaelis -Menc. Aujourd'hui, c'est toujours l'un des modèles qui est le plus utilisé pour décrire la cinétique enzymatique.
Concepts de base dans la cinétique enzymatique
Catalyse enzymatique
Les enzymes sont des protéines, avec des activités catalytiques, capables d'agir sur une molécule appelée substrat, catalysant sa transformation en une autre substance connue sous le nom de produit. Les enzymes ne sont pas consommées pendant leur action catalytique, restant leur masse constante.
Activité catalytique
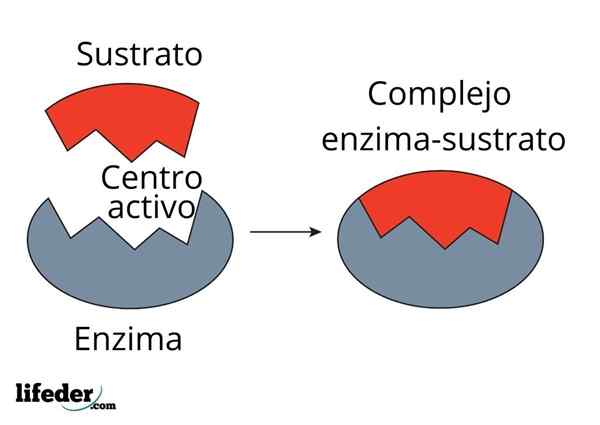
L'activité catalytique de l'enzyme est réalisée dans une structure spécialisée à trois dimensions connue sous le nom de centre actif. Ceci est formé par le pli de la chaîne de protéines enzymatiques qui détermine l'interaction d'un groupe d'acides aminés qui forment le centre actif.
Centre actif
Le centre actif n'est pas une structure rigide, mais capable de s'adapter géométriquement au substrat pour interagir avec lui. L'interaction est généralement faible (forces Van der Waals), bien qu'il existe des enzymes qui forment un lien covalent avec le substrat.
Peut vous servir: graisse butyrique: Obtention, types, composition, utilisations, avantagesDiminution de l'énergie d'activation
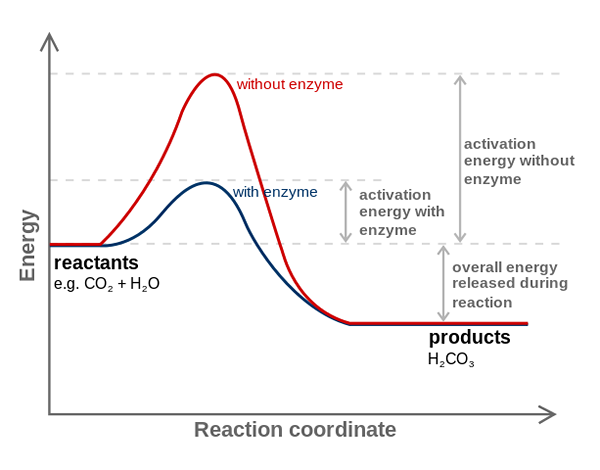 L'enzyme de l'anhydrase carbonique diminue l'énergie d'activation pour la conversion de CO2 à H2CO3. Source: fvasconcellos (discours • contribs), cc by-sa 3.0, via Wikimedia Commons
L'enzyme de l'anhydrase carbonique diminue l'énergie d'activation pour la conversion de CO2 à H2CO3. Source: fvasconcellos (discours • contribs), cc by-sa 3.0, via Wikimedia Commons Les enzymes catalysent les réactions diminuant l'énergie d'activation et, par conséquent, réduisant également la consommation d'énergie libre (g) nécessaire à l'achèvement du processus catalysé. Les enzymes ne modifient pas le point d'équilibre des réactions chimiques non catalysées.
Notez comment l'enzyme de l'anhydrase carbonique diminue l'énergie d'activation pour la co-conversion2 à H2CO3. Bien que la distance entre le rouge et la ligne bleuâtre ne semble pas beaucoup, cette enzyme augmente la vitesse de l'ordre de millions de fois (106), par rapport à la réaction effectuée sans leur participation.
Stéréo-spécificité
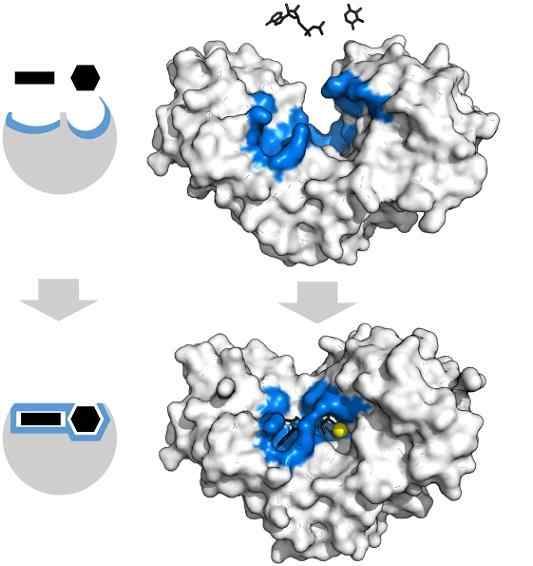 Les substrats d'adénosine tryphosphate et xylose ont la forme spécifique qui coïncide avec la géométrie du centre actif de l'enzyme de l'hexoquinase. Source: Thomas Shafee, CC par 4.0, via Wikimedia Commons
Les substrats d'adénosine tryphosphate et xylose ont la forme spécifique qui coïncide avec la géométrie du centre actif de l'enzyme de l'hexoquinase. Source: Thomas Shafee, CC par 4.0, via Wikimedia Commons Les enzymes, en général, sont très spécifiques aux réactions qu'ils catalysent, car les molécules de substrat doivent interagir avec le centre actif qui présente un ensemble d'exigences pour leur couplage avec elle.
Ainsi, par exemple, le centre actif de l'hexoquinase, qui est dynamique en raison des vibrations moléculaires des chaînes de protéines, offre des groupes en orientations spatiales exactes afin que l'adénosine et les molécules d'adénosine xylose, au chaux comme s'ils étaient des pièces remplissant géométrique.
La moindre perturbation physique ou chimique, et la région bleue -hexoquinase ne peut plus s'adapter aux substrats.
Vitesse maximum
Les enzymes ont un nombre limité de centres actifs, donc en augmentant la concentration de substrat. Cela détermine que la vitesse de la réaction catalysée ne peut pas augmenter au-delà d'une certaine valeur, connue sous le nom de vitesse maximale.
Sensibilité à la température et pH
L'activité catalytique enzymatique dépend de la température et du pH, ayant des valeurs optimales de ces paramètres pour son fonctionnement. De même, parce que ce sont les molécules de protéines enzymes, elles sont sensibles à une dénaturation chimique ou thermique.
Cofacteurs
Certaines enzymes augmentent leur activité catalytique en raison de l'influence de certains facteurs, qui peuvent être des métaux ou des composés organiques appelés coenzymes.
De même, les enzymes peuvent être inhibées de manière compétitive et non concurrentielle. Dans le cas de l'hexoquinase d'en haut, le Mg2+ (Sphère jaune) agit comme un cofacteur.
Vitesse de réaction enzymatique
La vitesse d'une réaction enzymatique dépend de la concentration de substrat et de concentration enzymatique. Lorsque la concentration du substrat est faible, il existe une relation presque linéaire entre la vitesse enzymatique et la concentration du substrat.
Il peut vous servir: pas de métaux: historique, propriétés, groupes, utilisationsPar conséquent, la vitesse enzymatique augmente en proportion directe avec la concentration du substrat; Mais en augmentant la concentration de substrat à une valeur qui sature les sites actifs de l'enzyme, la vitesse maximale est atteinte.
Une fois que la vitesse enzymatique se produit, elle devient constante, c'est-à-dire qu'elle est indépendante de la concentration du substrat et il est dit que la vitesse enzymatique est nul. De plus, la vitesse enzymatique catalytique est proportionnelle à la concentration du complexe enzymatique-substrat [IS].
Comme le montre l'expression mathématique:
V = k2[EST]
La vitesse maximale est directement proportionnelle à la concentration totale de l'enzyme, comme il apparaît dans la formule suivante:
VMax = KChatETt
KChat Il s'agit du numéro de rotation ou de remplacement et représente le nombre de molécules de substrat que chaque site enzymatique convertit en produit par unité de temps. Alors quet représente le nombre de sites enzymatiques catalytiques. Ouit Il a une valeur élevée, un [s] plus élevé est nécessaire pour saturer les sites ou centres actifs.
Équation de Michaelis -mente
Modèle
Le modèle de Mihaelis -mente est basé sur l'action des enzymes qui agissent sur un substrat simple et ne s'applique pas aux enzymes alostériques; c'est-à-dire ceux qui ont une région réglementaire de l'activité catalytique du site actif.
Les enzymes à une faible concentration de substrat, ont une activité catalytique linéaire avec la concentration de substrat; Mais à des concentrations élevées de substrat, l'activité catalytique est indépendante de la concentration du substrat.
En 1913, Leonor Michelis et Maud ont proposé un modèle pour expliquer le comportement enzymatique indiqué, l'existence d'un complexe intermédiaire intermédiaire enzymatique [est] important dans le modèle [IS].
Équation générale
La relation de ce complexe avec les autres composantes du processus enzymatique, ainsi qu'avec les constantes (k) qui les relient, sont indiquées dans le schéma suivant:
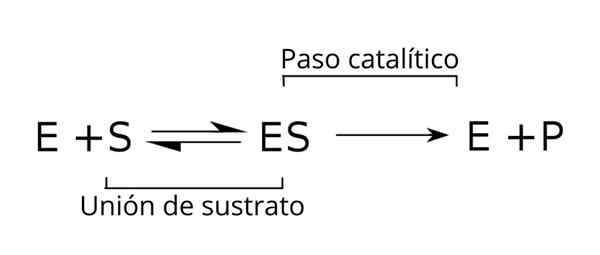 Équation générale des substrats, complexe enzymatique-substrat et produits de la cinétique enzymatique. Source: Tim Vickers via Wikipedia.
Équation générale des substrats, complexe enzymatique-substrat et produits de la cinétique enzymatique. Source: Tim Vickers via Wikipedia. L'enzyme (E) est combinée avec le (s) substrat pour former le complexe enzymatique-substrat avec une constante de vitesse K1. Le complexe E-S peut se dissocier en e et s avec une vitesse de réaction constante k-1.
De même, le complexe est peut provoquer un produit (P) et la séparation de l'enzyme, qui peut être recyclée pour répondre à un autre cycle d'activité enzymatique. Une situation d'équilibre peut être atteinte pour l'état [est] dans lequel sa vitesse de formation est égale à sa vitesse de décomposition.
Il peut vous servir: éléments chimiques naturelsK1[Est] [s] = (k-1 + K2) [Is] (1)
Regroupez les termes et la compensation [est], vous avez:
[Is] = ([e] [s]) / (k-1 + K2 / K1) (2)
KM = (K-1 + K2) / K1
KM C'est une constante introduite par Michaelis.
Termes de l'équation de Michaelis -mente
Remplacement maintenant kM Dans (2) nous continuons:
[Is] = [e] [s] / kM (3)
La concentration d'enzyme non combinée est:
[E] = [eT] - [es] (4)
Où [e] est l'enzyme libre et [eT] La concentration totale de l'enzyme.
Combiner les équations 3 et 4, ce qui rend les substitutions dues, et en tenant également compte du VMax, L'équation de Michaelis-Muene est atteinte, exprimée de la manière suivante:
V = (vMax [S]) / ([s] + kM)
La vitesse maximale de la réaction enzymatique se produit lorsque la concentration du substrat est beaucoup plus élevée que kM Et les sites catalytiques des enzymes sont saturés de substrat. Cela se produit lorsque la relation [s] / [s] + kM Approches de 1.
Quand [s] est égal à kM, La partie de l'équation [s] / [s] + kM est égal à 1/2, indiquant que kM C'est la concentration de substrat qui produit une vitesse de réaction enzymatique qui est la moitié de la vitesse maximale.
De plus, kM C'est une mesure de l'affinité d'une enzyme par le substrat: plus la valeur du K est grandeM, La mineure sera l'affinité de l'enzyme du substrat et vice versa. Par conséquent, à un kM La vitesse de la réaction enzymatique sera faible.
Graphique LineWeaver-Burk
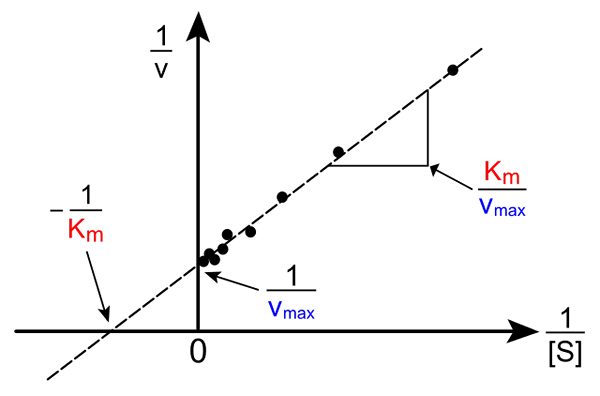 Lineweaver Burk Straight. Source: Pro Buger Catcher via Wikipedia.
Lineweaver Burk Straight. Source: Pro Buger Catcher via Wikipedia. La transformation de l'équation de Michaelis-Muene pour produire sa forme inverse a la forme suivante:
1 / v = (kM / VMax) (1 / [s]) + 1 / vMax
L'importance de cette ligne est qu'elle a une intersection avec l'axe x en - 1 / kM, et avec l'axe y à y = 1 / vMax (image supérieure). La ligne a une pente de kM/ Vmax. Cela permet des informations sur VMax et kM graphiquement l'inverse des vitesses en fonction de l'inverse des concentrations de substrat.
Les références
- Strayer, L. (1975). Biochimie. 2donner Édition. Éditorial Revered.
- L'Iran. Levine. (2009). Principes de la physicochimie. Sixième édition. Mc Graw Hill.
- Wikipédia. (2020). Cinétique enzymatique. Récupéré de: dans.Wikipédia.org
- Michael Blaber. (5 juin 2019). Cinétique enzymatique. Biology Libreretsxts. Récupéré de: bio.Bibliothèque.org
- Les éditeurs d'Enyclopaedia Britannica. (2020). Michaelis-Muen Kinetics. Récupéré de: Britannica.com
- Berg JM, Tymoczko JL, Stryer L. Biochimie. 5e édition. New York: W H Freeman; (2002). Section 8.4: Le modèle Michaelis explique les propriétés cinétiques de nombreuses enzymes. Récupéré de: NCBI.NLM.NIH.Gouvernement

