Structure d'acide tricloroacétique, propriétés, synthèse, utilisations, effets

- 4338
- 1343
- Adrien Remy
Il acide tricloroacétique C'est un composé organique solide dont la formule chimique est C2HCL3SOIT2 ou CCL3-COOH. Il est également connu sous le nom d'acide trichloroétanoïque et de TCA. C'est un acide monocarboxylique dans lequel les hydrogènes du deuxième atome de carbone ont été remplacés par du chlore. Ses cristaux sont incolores pour les blancs.
Le TCA est très soluble dans l'eau, générant des solutions très acides. Il peut précipiter les protéines d'une solution aqueuse. Un contact prolongé avec de l'acide trichloroacétique peut générer des brûlures cutanées.
 Cristaux d'acide tricloroacétique CCL3COOH. Lem [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons.
Cristaux d'acide tricloroacétique CCL3COOH. Lem [cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons. Cependant, cela a été utilisé avantageusement pour traiter les troubles cutanés, car il est utilisé dans la solution diluée et très contrôlée. Le TCA est également souvent utilisé dans le SO PEELING Chimiste pour le rajeunissement de la peau.
D'un autre côté, étant un composé organisé que l'on trouve dans l'environnement dans de petites proportions, il a été responsable comme cause possible de dommages aux forêts.
Malgré sa teneur en élément de chlore, il n'y a pas de données qui confirment si l'acide tricloroacétique est un cancérogène.
[TOC]
Structure
L'acide tricloroacétique est un acide monocarboxylique, c'est-à-dire qui contient un groupe de -COH unique. Votre squelette ne contient que 2 atomes de carbone. Est similaire à l'acide acétique ch3-COOH mais au lieu du groupe méthyl -ch3, Il a un groupe -Cl3, c'est-à-dire que sa formule est CCL3-COOH.
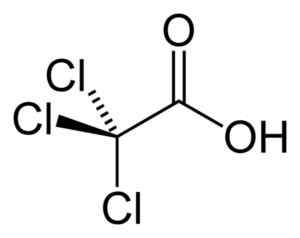 Structure de la molécule d'acide trichloroacétique CCL3-COOH. Benjah-bmm27 [domaine public]. Source: Wikipedia Commons.
Structure de la molécule d'acide trichloroacétique CCL3-COOH. Benjah-bmm27 [domaine public]. Source: Wikipedia Commons. Nomenclature
- Acide tricloroacétique
- Acide trichloroétanoïque
- 2,2,2-acide critique
- TCA (acronyme pour l'anglais Acide trichloroacetic)
Propriétés
État physique
Solide cristallin incolore à blanc. Ses cristaux sont Rhomboédica
Poids moléculaire
163,38 g / mol
Point de fusion
57,5 ºC
Point d'ébullition
195,5 ºC
Densité
1,6 g / cm3
Solubilité
Très bonne solubilité dans l'eau: 120 g / 100 ml à 25 ° C.
Soluble dans l'éthanol cho3Ch2Oh et dans l'éther dietyl3Ch2Och2Ch3. Légèrement soluble dans le tétrachlorure de carbone CCL4.
Peut vous servir: oxyde de béryl (Beeo)pH
Le pH d'une solution aqueuse avec 0,1 moles / L est de 1,2.
Constante de dissociation
PAQUETpour = 0,51 (signifie qu'il s'agit d'un acide plus fort que l'acide acétique)
Propriétés chimiques
L'acide tricloroacétique est un solide hygroscopique, absorbe l'humidité de l'air formant un liquide visqueux. Il a un acre ou une odeur épicée.
Lors de la dissolution dans l'eau, la libération de chaleur se produit. Il est corrosif vers des métaux tels que le fer, le zinc et l'aluminium, et vers les tissus biologiques. Il est extrêmement corrosif pour la peau humaine en contact prolongé.
Il a la propriété de protéines précipitées en solution.
Lorsqu'il est chauffé avec des alcalis à la décomposition émet une fumée de chloroforme toxique ch3Cl, acide chlorhydrique HCL, dioxyde de carbone2 et monoxyde de carbone.
Dans les sources consultées, il n'y a pas de consensus pour savoir s'il est cancérigène ou non.
La synthèse
Il est préparé au niveau industriel par chloration de l'acide acétique ch3-COOH, avec le chlore Cl2 en présence ou non des catalyseurs.
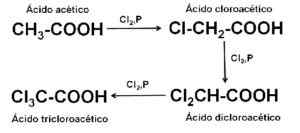 Synthèse d'acide tricloroacétique CCL3COOH. Auteur: Marilú Stea.
Synthèse d'acide tricloroacétique CCL3COOH. Auteur: Marilú Stea. Utilisation dans l'analyse des protéines
L'acide tricloroacétique est largement utilisé pour la détermination des protéines, comme l'albumine. C'est un agent très efficace pour ses précipitations, en particulier des solutions de protéines diluées.
Les précipitations se produisent spécifiquement et quantitativement, leur permettant de les séparer des autres substances non protéines, telles que les polysaccharides, les cations unies avec des protéines et les sels, et permet de dénaturer les protéases (enzymes qui permettent des protéines de rupture).
Selon la littérature consultée, on ne sait pas ce qu'est le mécanisme des précipitations. Il a été suggéré que la forme dominante pourrait être une agrégation hydrophobe, car il y a un intervalle, environ 15% de l'acide trifluoroacétique, dans lequel des précipitations optimales se produisent.
Utilisations thérapeutiques
Des solutions TCA diluées ont été utilisées avec succès dans le traitement de l'otite aiguë externe (douleur auditive dans la zone avant le tympan ou le canal auditif externe).
Le TCA désactive les cellules inflammatoires en modifiant leurs propriétés, en séchant la région enflammée, en réduisant l'œdème et en une douleur rapide. Il est également très toléré par les patients, les enfants et les adultes.
Peut vous servir: hydroxyde de baryum (BA (OH) 2)De plus, il restaure l'état acide de la zone, inhibant la prolifération des bactéries et des champignons dans la phase aiguë de la maladie. Son mécanisme d'action empêche la récidive et la progression de la maladie à la phase chronique.
Utilisation dans les traitements dermatologiques
Pour les troubles cutanés
Il a été utilisé dans le traitement de la kératose actinique, qui est une maladie cutanée caractérisée par une zone squameuse qui se forme dans les zones cutanées chroniques pendant des années aux rayonnements UV, tels que le visage, le cuira en cuir ou les avant-bras.
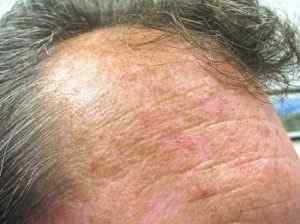 Kératose actinique. Future Famdoc [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons.
Kératose actinique. Future Famdoc [CC BY-SA 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]. Source: Wikipedia Commons. Un petit pourcentage de cette maladie entraîne un cancer de la peau, d'où l'importance de la traiter à temps.
Il est également utilisé pour la rosacée, la dermatite séborrhéique, l'acné, les xantelasmas (petites bosses grasses bénignes), les verrues, les taupes et l'hyperpigmentation.
La procédure est appelée brûler ou PEELING L'acide chimique et tricholoacétique est préféré sur d'autres composés chimiques en raison de leur sécurité, de leur efficacité et de leur non-toxicité systémique.
Le TCA détruit chimiquement l'épiderme et le derme supérieur de la zone traitée. Le nouvel épiderme migre des annexes cutanés sous le tissu détruit, après quoi les cortex sus-jacents émergent en quelques jours.
La régénération cutanée est évidente dans 2 à 3 semaines. Les changements histologiques dans la peau sont l'homogénéisation de l'architecture de collagène et une augmentation du tissu élastique dans le derme.
Ces changements sont permanents. De plus, les cellules anormales sont éliminées et remplacées par des cellules normales épidermiques.
Pour les traitements cosmétiques
Brûler ou exfoliation ou PEELING Avec l'acide tricloroacétique, il est également utilisé dans le traitement esthétique de la peau vieillie, des cicatrices d'acné et des tatouages.
 Les rides. Auteur: Kelsey Vere. Source: Pixabay.
Les rides. Auteur: Kelsey Vere. Source: Pixabay. Il peut produire une peau relativement profonde brûlée sans produire une toxicité systémique. Les traitements doivent toujours être effectués par du personnel formé et expérimenté.
Les variables pour prendre en compte le succès de la technique sont la concentration appropriée d'acide en fonction du type et de l'épaisseur de la peau, de la technique d'application, de l'efficacité de la préparation, de la densité et de l'activité précédentes des glandes sébacées et de l'application de Agents kératolithiques avant traitement.
Il peut vous servir: Hydroxyde de zinc (Zn (OH) 2)Chaque patient doit être évalué pour sélectionner la concentration appropriée et éviter les résultats désastreux.
Effet de la pollution du TCA
L'acide tricloroacétique est un composé chimique présent dans l'air, la pluie, la végétation et le sol. Pour cette raison, il a été impliqué comme responsable des effets néfastes sur certaines forêts et jungles.
 forêt de pins. Auteur: Paul Gilmore. Source: Unsetpash
forêt de pins. Auteur: Paul Gilmore. Source: Unsetpash Il y a une incertitude concernant les sources de la TCA dans l'environnement. Bien qu'il existe un consensus qui peut provenir de l'oxydation des solvants chlorés présents dans l'atmosphère, les concentrations de TCA trouvées dans les précipitations sont bien supérieures à ce qu'on s'attendrait à ce que ce soit de tels solvants.
Le TCA peut également se produire sur le sol et se dégrader dans ce. Les plantes peuvent prendre le TCA de l'air et du sol et être transportés des feuilles à la racine et vice versa. On estime qu'il est métabolisé dans le feuillage.
Dans les tests effectués par certains chercheurs en semis d'un type de pin traité avec des niveaux d'acide tricloroacétique similaires à ceux trouvés dans l'air dans certaines régions de l'Europe, des États-Unis et du Canada, il a été constaté qu'il n'y a pas de dommage visible aux plantes ou aux changements dans les changements dans la croissance de ceux-ci en raison du TCA.
Seule une certaine diminution de la teneur en protéines des plantes traitées avec TCA a été trouvée, peut-être en raison de la propriété de l'acide tricloroacétique des protéines précipitantes.
Les références
- Novák, P. et havlícek, v. (2016). Protéine d'extraction et de précipitation. En profilage protéomique et chimie analytique (deuxième édition). Récupéré de ScienceDirect.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Acide trichloroacetic. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Cape, n.J. et al. (2003). Exposition à long terme des semis d'épinette de Sitka à l'acide trichloroacétique. Environnement. SCI. Technol. 2003, 37, 2953-2957. Récupéré des pubs.ACS.org.
- Brodland, D.g. et al. (1988). Chemexfoliation de l'acide trichloroacétique (peeille chimique) pour les dommages actiniques prédignes étendus du visage et du cuir chevelu. May Clin Proc 63: 887-896, 1988. NCBI a récupéré.NLM.NIH.Gouvernement.
- Collins, P.S. (1989). Revue des peelings à l'acide trichloroacétique. Dermatol. Vibrer. Oncol. 1989; 15: 933-940. Récupéré de la bibliothèque en ligne.Wiley.com.
- Kantas, je. et al. (2007). L'utilisation de l'acide trichloroacétique dans le traitement de l'otite externe acotte. Eur Arch Irhinolaryngol (2007) 264: 9-14. NCBI a récupéré.Clm.NIH.Gouvernement.
- « Troisième loi des formules de thermodynamique, équations, exemples
- Quel rôle les gens jouent dans l'efficacité énergétique? »

