Acide tartrique
- 907
- 233
- Anaïs Julien
Nous expliquons ce qu'est l'acide tartrique, ses propriétés physiques et chimiques, sa structure et ses applications
Qu'est-ce que l'acide tartrique?
Il acide tartrique C'est un composé organique dont la formule moléculaire est COOH (CHOH)2COOH. Il a deux groupes carboxyle; C'est-à-dire que vous pouvez libérer deux protons (h+). En d'autres termes, c'est un acide diprotique. Il peut également être classé comme un acide aldarique (sucre acide) et un dérivé d'acide succinique.
Son sel est connu depuis des temps immémoriaux et constitue l'un des produits secondaires de l'élaboration du vin. Il est cristallisé comme un sédiment blanc baptisé comme des "diamants de vin", qui s'accumulent dans le bouchon ou au fond des barils et des bouteilles. Ce sel est le biitartre de potassium (ou tartrato d'acide potassium).
Les sels d'acide tartrique ont en commun la présence d'un ou deux cations (na+, K+. NH4+, CA2+, etc.) Parce qu'en libérant ses deux protons, il reste négativement chargé d'une charge de -1 (comme avec les sels de biterrato) ou -2.
À son tour, ce composé a fait l'objet d'études et d'enseignement des théories organiques liées à l'activité optique, plus précisément avec la stéréochimie.
Où est l'acide tartrique?
L'acide tartrique est une composante de nombreuses plantes et de la nourriture, comme l'abricot, les avocats, les pommes, les tamarindos, les graines de tournesol et les raisins.
Dans le processus de vieillissement des vins, cet acide - aux températures froides - est combiné avec du potassium pour cristalliser comme tartato. Dans les vins rouges, la concentration de ces tartrats est moindre, tandis que dans les vins blancs, ils sont plus abondants.
Les tartrates sont des sels de cristaux blancs, mais lorsqu'ils obtiennent des impuretés de l'environnement alcoolique, ils acquièrent des tons rougeâtre ou violets.
Peut vous servir: réaction de déplacementStructure d'acide tartrique
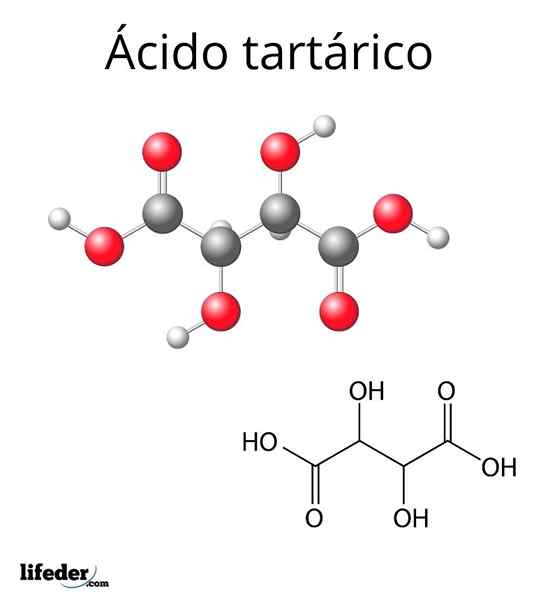
 Structure moléculaire de l'acide tartrique
Structure moléculaire de l'acide tartrique La structure moléculaire de l'acide tartrique est représentée dans l'image supérieure. Les groupes carboxyle (-cooh) sont situés aux extrémités latéraux et sont séparés par une courte chaîne de carbone (C2 et C3).
À son tour, chacun de ces carbones est lié à un H (sphère blanche) et à un groupe OH. Cette structure peut faire pivoter le lien C2-C3, générant ainsi plusieurs conformations qui stabilisent la molécule.
C'est-à-dire le lien central de la molécule cassée en tant que cylindre rotatif, alternant consécutivement la disposition spatiale des groupes -coooh, h et oh (projections de Newman).
Par exemple, dans l'image, les deux groupes OH pointent dans des directions opposées, ce qui signifie qu'ils sont en postes les uns avec les autres. Il en va de même pour les groupes -cooh.
Une autre conformation possible est celle de quelques groupes éclipsés, dans lesquels les deux groupes sont orientés dans la même direction. Ces conformations ne joueraient pas un rôle important dans la structure du composé si tous les groupes de carbones C2 et C3 Ils étaient les mêmes.
Comme dans ce composé, les quatre groupes sont différents (-cooh, oh, h et l'autre côté de la molécule), les carbones sont asymétriques (ou chiraux) et présentent la célèbre activité optique.
La façon dont les groupes sont disposés en carbones2 et C3 de l'acide tartrique détermine différentes structures et propriétés pour le même composé; c'est-à-dire permet l'existence de stéréoisomères.
Applications d'acide tartrique
Dans l'industrie alimentaire
Il est utilisé comme stabilisateur d'élulsion dans les boulangeries. Il est également utilisé comme ingrédient pour la levure, la confiture, la gélatine et les boissons gazeuses. Il remplit également les fonctions comme une bibliothèque acidifiante et soumissionnaire d'ion.
Il peut vous servir: bromure de sodium (NABR)L'acide tartrique se trouve dans ces aliments: biscuits sucrés, bonbons, chocolats, liquides gazeux, produits de boulangerie et vins.
Dans l'élaboration des vins, il est utilisé pour les rendre plus équilibrés, du point de vue gustatif, en diminuant le pH de ces.
Dans l'industrie pharmaceutique
Il est utilisé dans la création de pilules, d'antibiotiques et de pilules effervescentes, ainsi que dans les médicaments utilisés dans le traitement des maladies cardiaques.
Dans l'industrie chimique
Il est utilisé en photographie, ainsi que dans la galvanotechnique et est un antioxydant idéal pour les graisses industrielles.
Il est également utilisé comme kidnappeur en ion métallique. Comme? Faire tourner leurs liens de telle manière que vous pouvez localiser les atomes d'oxygène du groupe carbonyle, riches en électrons, autour de ces espèces chargées positivement.
Dans l'industrie de la construction
Retarder le processus de durcissement du plâtre, du ciment et du plâtre, ce qui rend la manipulation de ces matériaux plus efficace.
Propriétés de l'acide tartrique

Les applications d'acide tararique les plus courantes sont:
- L'acide tartrique est commercialisé sous forme de poudre cristalline ou de cristaux blancs légèrement opaques. Il a un goût agréable, et cette propriété est révélatrice d'un vin de bonne qualité.
- Fond à 206 ºC et brûle à 210 ºC. Il est très soluble dans l'eau, les alcools, les solutions de base et le borax.
- Sa densité est de 1,79 g / ml à 18 ºC et présente deux constantes d'acidité: PKA1 et pka2. C'est-à-dire que chacun des deux protons acides a sa propre tendance à se libérer dans l'environnement aqueux.
- Comme les groupes -coh et OH, il peut être analysé par spectroscopie infrarouge (IR) pour leurs déterminations qualitatives et quantitatives.
- D'autres techniques telles que la spectroscopie de masse et la résonance magnétique nucléaire, permettent l'analyse précédente de ce composé.
Stéréochimie

L'acide tartrique était le premier composé organique auquel une résolution énantiomérique a été développée. Qu'est-ce que cela signifie? Cela signifie que ses stéréoisomères pourraient être séparés manuellement grâce aux travaux de recherche du biochimiste Louis Pasteur, en 1848.
Et quels sont les stéréoisomères de l'acide tartrique? Ce sont: (R, R), (s, s) et (r, s). R et S sont les configurations spatiales des carbones C2 et C3.
L'acide tartrique (R, R), le plus "naturel", fait pivoter la lumière polarisée vers la droite; L'acide tartrique (S) est brisé à gauche, contrairement aux aiguilles d'horloge. Et enfin, l'acide tartrique (R, S) ne casse pas la lumière polarisée, étant optiquement inactif.
Louis Pasteur, à l'aide d'un microscope et des pincettes, des cristaux d'acide tartrique trouvés et séparés qui présentaient des motifs "droite" et "à gauche", comme dans l'image supérieure.
De cette façon, les cristaux "handicapés" sont ceux formés par l'énantiomère (R, R), tandis que les cristaux "à gauche" sont ceux de l'énantiomère (s, s).
Cependant, les cristaux de l'acide tartrique (R, S) ne diffèrent pas des autres, car ils présentent des caractéristiques qualifiées et gauche en même temps; Par conséquent, ils ne pourraient pas être "résolus".
Les références
- Wikipédia. (2018). Acide tartrique. Récupéré de.Wikipédia.org
- Se publier. (2018). Acide tartrique. Récupéré de pubchem.NCBI.NLM.NIH.Gouvernement.
- Comprendre les tartates du vin. Récupéré de Jordanwinery.com
- Actif. Acide tartrique. Récupéré de Agipedia.org
- Pochteca. Acide tartrique. Pochteca a récupéré.com.mx
- Dhanesshwar Singh et al. (2012). Sur l'origine de l'inactivité optique de l'acide méso-tartarien. Département de chimie, Université de Manipur, Canchipur, Imphal, Inde. J. Chem. Pharmade. Bœuf., 4 (2): 1123-1129.

