Structure d'acide sulfhydrique (H2S), propriétés, utilisations, importance
- 4035
- 49
- Anaïs Julien
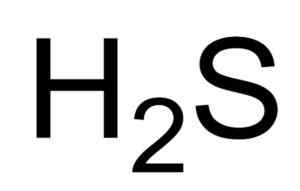
Il acide sulfhydrique o Le sulfure d'hydrogène est un gaz formé par l'union d'un atome de soufre et de deux atomes d'hydrogène (H). Sa formule chimique est H2S. Il est également connu sous le nom de sulfure de gaz. C'est un gaz incolore dont l'odeur devient évidente dans les œufs pourris.
Il est présent dans les volcans et les sources chaudes sulfureuses, dans le gaz naturel et le pétrole brut. Il est également formé pendant la décomposition anaérobie (sans oxygène) de la matière organique végétale et animale. Il se produit naturellement dans le corps des mammifères, à travers l'action de certaines enzymes sur la cystéine, un acide aminé non essentiel.
 Formule chimique d'acide sulfhydrique ou de sulfure d'hydrogène. Saranphong Yimklan [domaine public]. Source: Wikimedia Commons.
Formule chimique d'acide sulfhydrique ou de sulfure d'hydrogène. Saranphong Yimklan [domaine public]. Source: Wikimedia Commons. Les solutions aqueuses de H2S sont corrosifs pour les métaux tels que l'acier. Le H2S est un composé réducteur qui, lorsqu'il réagit avec le SO2 , Il oxyde le soufre élémentaire tout en réduisant à SO2 Aussi au soufre.
En dépit d'être un composé hautement toxique et mortel pour l'homme et les animaux, depuis quelques années, son importance a été étudiée dans une série de processus importants dans le corps.
Régule une série de mécanismes liés à la génération de nouveaux vaisseaux sanguins et au fonctionnement du cœur.
Protéger les neurones et avoir pensé à son action contre des maladies telles que Parkinson et Alzheimer.
En raison de sa réduction chimique, peut combattre les espèces oxydantes, agissant ainsi contre le vieillissement cellulaire. Pour ces raisons, la possibilité de produire des médicaments est à l'étude qui, lorsqu'elle est fournie aux patients, peut la libérer lentement dans le corps.
Cela servirait à traiter les pathologies telles que l'ischémie, le diabète et les maladies neurodégénératives. Cependant, leur mécanisme d'action et leur sécurité doivent toujours être étudiés en profondeur.
[TOC]
Structure
La molécula H2S est analogue à celui de l'eau, c'est-à-dire qu'ils ressemblent à leur forme parce que les hydrogènes sont situés formant un angle avec le soufre.
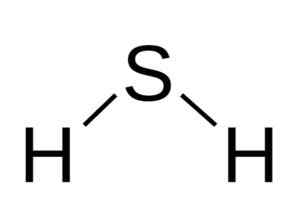 Structure angulaire de la molécule d'acide sulfure, H2S. Bangin [cc by-sa 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons.
Structure angulaire de la molécule d'acide sulfure, H2S. Bangin [cc by-sa 3.0 (http: // CreativeCommons.Org / licences / by-sa / 3.0 /]]. Source: Wikimedia Commons. Soufre en h2S a la configuration électronique suivante:
12, 2s2 2 P6, 3s2 3p6,
Ensuite, prenez un électron de chaque hydrogène pour compléter sa couche de valence.
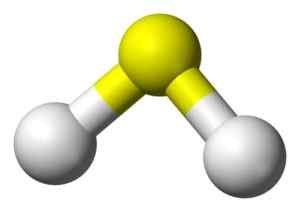 Structure 3D de l'acide sulfure. Jaune: soufre. Blanc: hydrogène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons.
Structure 3D de l'acide sulfure. Jaune: soufre. Blanc: hydrogène. Benjah-bmm27 [domaine public]. Source: Wikimedia Commons. Nomenclature
- Acide sulfhydrique
- Sulfure d'hydrogène
- Hydrure de soufre.
Propriétés physiques
État physique
Gaz incolore d'une odeur très désagréable.
Poids moléculaire
34,08 g / mol.
Point de fusion
-85,60 ºC.
Point d'ébullition
-60,75 ºC.
Densité
1 1906 g / L.
Solubilité
Modérément soluble dans l'eau: 2,77 volumes dans 1 eau à 20 ºC. Il peut être expulsé complètement de la solution aqueuse en le soumettant à l'ébullition.
Propriétés chimiques
En solution aqueuse
Lorsque le sulfure d'hydrogène est en solution aqueuse, le nom de l'acide sulfhydrique est affecté. C'est un acide faible. Il a deux protons ionisables:
H2S + H2Ou ⇔ h3SOIT+ + HS-, KA1 = 8,9 x 10-8
HS- + H2Ou ⇔ h3SOIT+ + S2-, KA2 ∼ 10-14
Le premier proton est légèrement ionisé, comme peut être déduit de sa première constante d'ionisation. Le deuxième proton est très peu ionisé, mais les solutions de H2S contiennent quelque chose de l'anion soufre S2-.
Si la solution H2S est exposé à l'air, le o2 Oxida à l'anion sulfure et le soufre précipite:
Peut vous servir: oxydes2 s2- + 4 h+ + SOIT2 → 2 h2O + 2 S0↓ (1)
En présence de chlore Cl2, Bromo br2 et iode je2 L'hydrogène et le soufre correspondants se forment:
H2S + br2 → 2 HBR + S0↓ (2)
Les solutions aqueuses de H2S sont corrosifs, produisent des fissures de stress avec du sulfure dans des aciers riches élevés. Les produits de corrosion sont du fer et du sulfure d'hydrogène.
Réaction d'oxygène
Le H2S réagit avec l'oxygène de l'air et les réactions suivantes peuvent se produire:
2 h2S + 3 O2 → 2 h2O + 2 SO2 (3)
2 h2S + O2 → 2 h2O + 2 S0↓ (4)
Réaction avec les métaux
Il réagit avec divers métaux qui se déplacent vers l'hydrogène et forment du sulfure métallique:
H2S + PB → PBS + H2↑ (5)
Réaction avec le dioxyde de soufre
Dans les gaz volcaniques, les H sont présents2S et le SO2, qui réagissent entre eux et le soufre solide se forme:
H2S + SO2 → 2 h2O + 3 S0↓ (6)
Décomposition avec température
Le sulfure d'hydrogène n'est pas très stable, il est facilement brisé par chauffage:
H2S → H2↑ + S0↓ (7)
Emplacement dans la nature
Ce gaz se trouve naturellement dans des sources chaudes sulfide ou sulfureuses, dans les gaz volcaniques, dans le pétrole brut et le gaz naturel.
 Eau sulfureuse manantiale. Николай максиousse.0 (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons.
Eau sulfureuse manantiale. Николай максиousse.0 (https: // CreativeCommons.Org / licences / par / 3.0)]. Source: Wikimedia Commons. Lorsque le pétrole (ou le gaz) contient des traces importantes de H2S est dit "aigre", contrairement à "doux", c'est quand il ne le contient pas.
Petites quantités de h2S dans le pétrole ou le gaz sont économiquement nocifs car une usine de lavage doit être installée pour l'enlever, à la fois pour éviter la corrosion et pour rendre le gaz résiduel sûr pour une utilisation domestique comme carburant.
Il se produit chaque fois que la matière organique qui contient du soufre est décomposée dans des conditions anaérobies (absence d'air), comme l'homme, les animaux et les déchets végétaux.
 H Émissions2S (couleur verte bleuâtre) sur la côte de la Namibie, photographiée par la NASA. Ces émissions proviennent des déchets organiques. Observatoire de la Terre de la NASA [CC par 2.0 (https: // CreativeCommons.Org / licences / par / 2.0)]. Source: Wikimedia Commons.
H Émissions2S (couleur verte bleuâtre) sur la côte de la Namibie, photographiée par la NASA. Ces émissions proviennent des déchets organiques. Observatoire de la Terre de la NASA [CC par 2.0 (https: // CreativeCommons.Org / licences / par / 2.0)]. Source: Wikimedia Commons. Les bactéries présentes dans la bouche et dans le tractus gastro-intestinal le produisent à partir des matériaux dégradables que les légumes ou les protéines animales contiennent.
Son odeur caractéristique provoque la prévention de sa présence dans les œufs pourris.
Le H2S il se produit également dans certaines activités industrielles, comme dans les raffineries de pétrole, les fours à coke, les usines de papier, vous auriez et dans la transformation des aliments.
Synthèse dans le corps des mammifères
Le H2S endogène peuvent se produire dans les tissus des mammifères, parmi ces êtres humains, par deux voies, une enzymatique et non enzymatique.
Le chemin non enzymatique consiste à réduire le soufre élémentaire0 à H2S par l'oxydation du glucose:
2 c6H12SOIT6 (glucose) + 6 s0 (soufre) + 3 h2O → 3 C3H6SOIT3 + 6 h2S + 3 CO2 (8)
Peut vous servir: chlore: histoire, propriétés, structure, risques, utilisationsLe chemin enzymatique se compose de h h2S de la l-cystéine, qui est un acide aminé synthétisé par le corps. Le processus est assuré par plusieurs enzymes, comme la cystation.
 L'acide sulfhydrique a été trouvé dans le cerveau des vaches. Auteur: Arttower. Source: Pixabay.
L'acide sulfhydrique a été trouvé dans le cerveau des vaches. Auteur: Arttower. Source: Pixabay. Obtention en laboratoire ou industriellement
Hydrogène gazeux (H2) Et l'élément de soufre ne réagit pas aux températures environnementales normales, mais au-dessus de celles-ci, elles commencent à être combinées, la température optimale étant de 310 ºC.
Le processus est néanmoins trop lent, donc d'autres méthodes sont utilisées pour l'obtenir, parmi celles suivantes.
Les sulfures métalliques (comme le sulfure ferreux) réagissent avec les acides (comme le chlorhydrique) en solution diluée.
FES + 2 HCL → FECL2 + H2S ↑ (9)
De cette façon, le gaz est obtenu2S, compte tenu de sa toxicité, doit être collecté en toute sécurité.
Utilisation industrielle de H2S pour produire du soufre
Stockage et transport en grandes quantités de h2S qui se sépare du gaz naturel en lavant avec des amines est difficile, donc le processus de claus est utilisé pour le transformer en soufre.
 Dans les raffineries d'huile, le H est séparé2S de gaz naturel en lavant avec des amines puis devient soufre. Auteur: Satyaprem. Source: Pixabay.
Dans les raffineries d'huile, le H est séparé2S de gaz naturel en lavant avec des amines puis devient soufre. Auteur: Satyaprem. Source: Pixabay. Dans ce processus, deux réactions se produisent. Dans le premier le h2S réagit avec l'oxygène pour donner ainsi2, Comme mentionné ci-dessus (voir réaction 3).
Le second est une réaction catalysée par l'oxyde de fer où le SO2 est réduit et h2S oxydants et les deux produisent du soufre (voir réaction 6).
De cette façon, le soufre est obtenu, qui peut être facilement stocké et transporté, ainsi qu'à l'allocation à plusieurs utilisations.
Utilité ou importance de H2S endogène dans l'organisme
Le H2S endogène est celui qui se produit naturellement dans l'organisme dans le cadre du métabolisme normal chez l'homme, les mammifères et les autres êtres vivants.
Malgré sa réputation de longue date d'être un gaz toxique et toxique associé à la décomposition de la matière organique, plusieurs études récentes des années 2000 à nos jours ont déterminé que H2S Endogen est un régulateur important de certains mécanismes et processus dans l'être vivant.
Le H2S présente une lipofilicité élevée ou une affinité envers les graisses, donc elle traverse facilement les membranes cellulaires, pénétrant tous les types de cellules.
Système cardiovasculaire
Chez les mammifères, l'acide sulfure favorise ou régule une série de signaux qui régulent le métabolisme, la fonction cardiaque et la survie cellulaire.
Il exerce un effet puissant sur le cœur, les vaisseaux sanguins et les éléments de sang circulant. Module le métabolisme cellulaire et la fonction mitochondriale.
Défend les reins des dommages causés par l'ischémie.
Système digestif
Jouer un rôle important en tant que facteur de protection contre les dommages à la muqueuse gastrique. Il est estimé être un médiateur important de la motilité gastro-intestinale.
Il est probable qu'il soit impliqué dans le contrôle de la sécrétion d'insuline.
Système nerveux central
Il agit également dans des fonctions importantes du système nerveux central et protège les neurones de stress oxydatif.
 Les neurones sont protégés par H2S endogène. Auteur: Gerd Altmann. Source: Pixabay.
Les neurones sont protégés par H2S endogène. Auteur: Gerd Altmann. Source: Pixabay. On estime qu'il peut protéger contre les maladies neurodégénératives telles que la maladie de Parkinson, Alzheimer et Hunginton.
Organe de vision
Protéger les cellules photorécepteurs de la dégénérescence rétinienne induite par la lumière.
Il peut vous servir: carbonate de lithium (LI2CO3): structure, propriétés, utilisationsContre le vieillissement
Le H2S étant une espèce réductrice peut être consommée par une variété d'agents oxydants circulant dans le corps. Combattre les espèces oxydantes telles que les espèces réactives de l'oxygène et les espèces réactives d'azote dans le corps.
Limitez les réactions des radicaux libres par l'activation des enzymes antioxydantes qui protègent contre les effets du vieillissement.
Potentiel de guérison de H2S fourni de manière exogène
La biodisponibilité de H2S endogénique dépend de certaines enzymes impliquées dans la biosynthèse de la cystéine chez les mammifères.
Certaines études suggèrent qu'un donneur de thérapie médicamenteuse Don2S pourrait être bénéfique pour certaines pathologies.
Par exemple, il pourrait être utile chez les patients diabétiques, car il a été observé que les vaisseaux sanguins des animaux diabétiques s'améliorent avec des médicaments qui fournissent H2S exogène.
Le H2S fourni de manière exogène augmente l'angiogenèse ou la formation de vaisseaux sanguins, il pourrait donc servir le traitement des maladies d'ischémie chronique.
Des médicaments sont conçus qui peuvent libérer H2S lentement pour pouvoir agir de manière bénéfique sur diverses maladies. Cependant, l'efficacité, la sécurité et les mécanismes de leur action doivent toujours être étudiés.
Des risques
Le H2S est un poison mortel s'il est inhalé pur ou même dilué 1 partie de gaz dans 200 parties d'air. Les oiseaux sont très sensibles à H2S et meurent même en dilution de 1 sur 1500 parties d'air.
 Acide sulfure ou sulfure d'hydrogène H2S est un poison puissant. Auteur: Openicons. Source: Pixabay.
Acide sulfure ou sulfure d'hydrogène H2S est un poison puissant. Auteur: Openicons. Source: Pixabay. Le H2S est un puissant inhibiteur de certaines enzymes et des processus de phosphorylation oxydative, ce qui conduit à la suffocation cellulaire. La plupart des gens le perçoivent olfitorly à des concentrations supérieures à 5 ppb (parties par milliard). Les concentrations de 20 à 50 ppm (parties par million) sont irritantes pour les yeux et les voies respiratoires.
Une inhalation de 100-250 ppm pendant quelques minutes peut générer un manque de coordination, des troubles de la mémoire et des troubles moteurs. Lorsque la concentration est d'environ 150-200 ppm2S. Si une concentration de 500 ppm est inhalée pendant 30 minutes, un œdème pulmonaire et une pneumonie peuvent être produits.
Les concentrations de plus de 600 ppm peuvent être mortelles dans les 30 premières minutes, car le système respiratoire est paralysé. Et 800 ppm est la concentration qui est immédiatement mortelle pour l'être humain.
Par conséquent, il convient d'éviter qu'il y a des échapis2S dans les laboratoires, local ou n'importe où ou situation.
Il est important d'alerter que de nombreux décès surviennent parce que les gens entrent dans des espaces confinés pour sauver les collègues ou les membres de la famille qui se sont effondrés en raison d'un empoisonnement avec H2S, les mourir aussi.
C'est un gaz inflammable.
Les références
- Panthi, s. et al. (2016). Importance physiologique du sulfure d'hydrogène: neuroprotecteur et neuromodulateur émergent. Médecine oxydative et longévité cellulaire. Volume 2016. ID d'article 9049782. Hyndawi a récupéré.com.
- Shefa, u. et al. (2018). Fonctions antioxydantes et signalisation des cellules du sulfure d'hydrogène dans le système nerveux central. Médecine oxydative et longévité cellulaire. Volume 2018. ID d'article 1873962. Hyndawi a récupéré.com.
- Tabassum, R. et al. (2020). Importance thérapeutique du sulfure d'hydrogène dans les maladies neurodégénératives associées à l'âge. Neural Regen Res 2020; 15: 653-662. Nrronline a récupéré.org.
- Martelli, un. et al. (2010). Sulfure d'hydrogène: nouvelle opportunité de découverte de médicaments. Revues de recherche médicinale. Volume 32, numéro 6. Récupéré de la bibliothèque en ligne.Wiley.com.
- Wang, m.-J. et al. (2010). Mécanismes d'angiogèse: rôle du sulfure d'hydrogène. Pharmacologie et physiologie cliniques et expérimentales (2010) 37, 764-771. Récupéré de la bibliothèque en ligne.Wiley.com.
- Dalefield, R. (2017). Fumée et autres toxiques inhalées. Sulfure d'hydrogène. En toxicologie vétérinaire pour l'Australie et la Nouvelle-Zélande. Récupéré de ScienceDirect.com.
- Selley, R.C. et Sonnenberg, S.POUR. (2015). Les propriétés physiques et chimiques du pétrole. Sulfure d'hydrogène. Dans les éléments de la géologie du pétrole (troisième édition). Récupéré de ScienceDirect.com.
- Hocking, m.B. (2005). Soufre et acide sulfurique. Conversion de procédé de Claus de sulfure d'hydrogène en soufre. Dans Handbook of Chemical Technology and Pollution Control (troisième édition). Récupéré de ScienceDirect.com.
- Lefer, D.J. (2008). Importance potentielle des altérations du sulfure d'hydrogène (h2S) Biodisponibilité du diabète. British Journal of Pharmacology (2008) 155, 617-619. Récupéré de bpspubs.Bibliothèque en ligne.Wiley.com.
- OU.S. Bibliothèque nationale de médecine. (2019). Sulfure d'hydrogène. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement.
- Port, J.POUR. Et Ibarz, J. (1965). Chimie générale moderne. 7e édition. Éditorial de Marín, s.POUR.
- « Origine de l'éducation socialiste, caractéristiques, principes, exemples
- Histoire du théâtre néoclassique, caractéristiques, représentants, œuvres »

