Hypoyodoso Acid (HIO)
- 3471
- 820
- Raphaël Charles
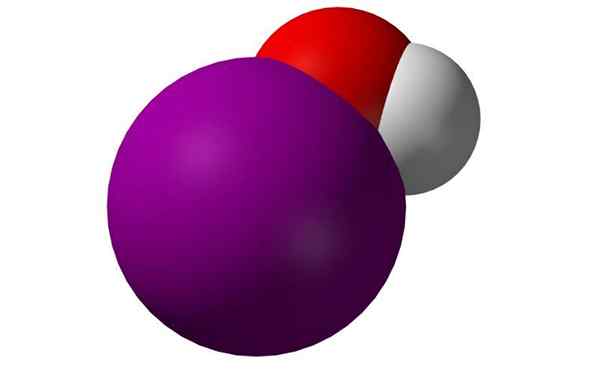
 Molécule d'acide hypoyodose. Source: Benjah-Bmm27, Wikimedia Commons
Molécule d'acide hypoyodose. Source: Benjah-Bmm27, Wikimedia Commons Qu'est-ce que l'acide de l'hypoyodose?
Il acide d'hypoyodose, Également connu sous le nom de monoxoyodate (i) d'hydrogène ou de yodol, il s'agit d'un composé inorganique de la formule de Hio. C'est un oxacide d'iode, avec un atome d'oxygène, un d'hydrogène et un d'iode avec un état d'oxydation 1+.
Le composé est très instable, car il a tendance à subir une réaction de décimation où il est réduit à l'iode moléculaire et oxyde l'acide d'iodose selon la réaction: 5Hio → 2i2 + Hio3 + 2h2SOIT.
Le composé est l'acide le plus faible des oxacides halogènes avec l'état d'oxydation 1+. Les sels de cet acide sont connus sous le nom d'hypoyoditos.
Ces sels sont plus stables que l'acide et se forment de manière similaire que leurs homologues chlore et brome, réagissant à l'iode moléculaire avec des hydroxydes métalliques alcalins ou alcaline.
L'acide hypoyodoso est produit par réaction d'iode moléculaire avec de l'oxyde de mercure (II), selon la réaction:
2i2 + 3hgo + h₂o → 2hio + hgi2 ● 2hgo
Des traces du composé sont également obtenues en réagissant à l'iode moléculaire avec de l'hydroxyde de potassium pour former, initialement, l'iodure de potassium et l'hypoyodite de potassium selon la réaction:
Toi2 + 2koh → ki + kio
Cependant, l'acide hypoyode, étant un acide aussi faible, rend l'hydrolyisation de l'hypoyodite de potassium, à moins qu'il y ait un excès d'hydroxyde de potassium.
Kio + h₂o → hio + koh
Il peut également être obtenu, comme ses homologues de chlore et de brome, faisant de l'iode moléculaire avec de l'eau réagi.
Cependant, étant donné son équilibre constant de l'équilibre, qui est de l'ordre de 10-13, Les quantités obtenues sont très petites.
Il peut vous servir: combien d'électrons de garde?Proprietes physiques et chimiques
- L'acide d'hypoyodose n'existe que sous forme de solution aqueuse, qui est jaunâtre. Le composé à l'état solide n'a pas été en mesure d'isoler, donc la plupart de ses propriétés sont théoriquement obtenues par calculs de calcul.
- L'acide hypoyodose a un poids moléculaire de 143 911 g / mol, un point de fusion de 219,81 ° C, un point d'ébullition de 544,27 ° C et une pression de vapeur de 6,73 x 10-14 Milimers de mercure.
- La molécule est très soluble dans l'eau, pouvant se dissoudre entre 5,35 x 105 et 8,54 x 105 grammes composés d'un litre de ce solvant.
- Hio est un fort oxydant et peut former des mélanges explosifs.
- Il est également un agent réducteur, étant capable d'oxyder les formes iodique, yodium et acide acide. Dans les solutions aqueuses, étant un acide faible, il est partiellement dissocié dans l'ion hypoyodite (Oi-) et h+.
- Le Hio réagit avec les bases pour former des sels appelés Hypoyoditos. Par exemple, l'hypoyodite de sodium (Naoi) est formé en réagissant de l'acide hypoyode avec de l'hydroxyde de sodium.
Hoi + naoh → naoi + h₂o
- L'acide hypoyodoso réagit également facilement avec une variété de molécules organiques et biomolécules.
Réactivité et dangers
L'acide de l'hypoyodose est un composé instable décomposant l'iode élémentaire. L'iode est un composé toxique qui doit être manipulé soigneusement.
L'acide de l'hypoyodose est dangereux en cas de contact avec la peau et les yeux (irritant) et en cas d'ingestion et d'inhalation.
En cas de contact visuel, vous devez vérifier si les lentilles de contact sont utilisées et les retirer immédiatement. Les yeux doivent être rincés à l'eau courante pendant au moins 15 minutes, en gardant les paupières ouvertes. L'eau froide peut être utilisée. Aucun drap ne doit être utilisé.
Peut vous servir: Vanadium: histoire, propriétés, structure, utilisationsSi le produit chimique entre en contact avec les vêtements, conservez-le le plus rapidement possible, en protégeant ses propres mains et son corps. Placer la victime sous une douche de sécurité.
Si le produit chimique s'accumule dans la peau exposée de la victime, comme les mains, la peau contaminée par de l'eau courante et du savon non abrasif est doucement lavée et soigneusement. L'eau froide peut être utilisée. Si l'irritation persiste, consulter un médecin. Lavez les vêtements contaminés avant de l'utiliser à nouveau.
Si le contact de la peau est grave, il doit être lavé avec un savon désinfectant et couvrir la peau contaminée par une crème antibactérienne.
En cas d'inhalation, la victime devrait être autorisée à se tenir dans une zone bien ventilée. Si l'inhalation est grave, la victime doit être évacuée dans une zone sûre dès que possible. Desserrer les vêtements serrés, comme des cou de chemise, des ceintures ou une cravate.
Si la victime est difficile à respirer, l'oxygène doit être administré. Si la victime ne respire pas, une réanimation buccale est faite. Compte tenu toujours de prendre en compte que cela peut être dangereux pour la personne qui fournit une aide à la réanimation bouche à bouche lorsque le matériau inhalé est toxique, infectieux ou corrosif.
En cas d'ingestion, il n'induit pas de vomissements. Dans tous les cas, des soins médicaux immédiats doivent être recherchés.
Applications
- L'acide d'hypoyodose est utilisé comme un puissant agent oxydant et comme agent réducteur dans les réactions de laboratoire.
- Il est utilisé pour produire des composés chimiques appelés hypoyodites.
- Des méthodes spectrophotométriques sont également utilisées pour mesurer la formation d'acide hypoyode pour surveiller les réactions où l'iode est impliqué.
Peut vous servir: réaction de déplacementLes haluros sont incorporés dans les aérosols, où ils commencent la destruction catalytique de l'ozone (ou3) Sur les océans et affecter la troposphère mondiale. Deux problèmes environnementaux intrigants qui subissent une étude continue sont: comprendre comment les halogènes moogènes moogènes en phase gazeuse réactive sont produits directement à partir d'halogénures inorganiques exposés à ou3 et restreindre les facteurs environnementaux qui contrôlent ce processus interfacial.
Les références
- Acide hypoïde. Récupéré d'EBI.CA.ROYAUME-UNI.
- Centre national d'information sur la biotechnologie. Récupéré de pubchem.

