Caractéristiques de l'acide glutamique, fonctions, biosynthèse

- 3083
- 768
- Paul Dumas
Il acide glutamique C'est l'un des 22 acides aminés qui composent les protéines de tous les êtres vivants et l'un des plus abondants dans la nature. Étant donné que le corps humain a des voies intrinsèques pour la biosynthèse, cela n'est pas considéré comme essentiel.
Avec l'acide aspartique, l'acide glutamique appartient au groupe d'acides aminés polaires chargés négativement et, selon les deux systèmes de nomenclature existants (trois ou une lettre), il est désigné comme «Glu" ou comment "ET".
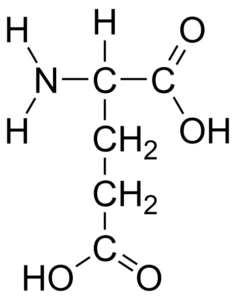 Structure d'acides aminés acide glutamique (source: HBF878 [CC0] via Wikimedia Commons)
Structure d'acides aminés acide glutamique (source: HBF878 [CC0] via Wikimedia Commons) Cet acide aminé a été découvert en 1866 par le chimiste allemand Ritterhause alors qu'il étudiait le gluten de blé hydrolysé, d'où sa dénomination "glutamique". Après sa découverte, sa présence dans une grande partie des êtres vivants a été déterminée, il est donc pensé qu'elle a des fonctions essentielles pour la vie.
El ácido L-glutámico se considera como uno de los más importantes mediadores en la transmisión de señales excitatorias en el sistema nervioso central de los animales vertebrados y también es necesario para el funcionamiento normal del cerebro, así como para el desarrollo cognitivo, la memoria y l'apprentissage.
Certains de ses dérivés, en outre, ont des fonctions importantes au niveau industriel, en particulier en ce qui concerne les préparations culinaires, car elle aide à améliorer le goût des repas.
[TOC]
Caractéristiques
Bien qu'il ne soit pas un acide aminé essentiel pour les humains, le glutamate (la forme ionisée de l'acide glutamique) a des implications nutritionnelles importantes pour la croissance animale et a été proposé qu'il avait une valeur nutritive beaucoup plus grande que celle d'autres acides aminés non essentiels.
Cet acide aminé est particulièrement abondant dans le cerveau, en particulier dans l'espace intracellulaire (cytosol), qui permet l'existence d'un gradient entre le cytosol et l'espace extracellulaire, qui est délimité par la membrane plasmatique des cellules nerveuses.
Parce qu'il a de nombreuses fonctions dans les synapses excitatrices et pour exercer ses fonctions agissant sur des récepteurs spécifiques, sa concentration est maintenue à des niveaux contrôlés, en particulier dans l'environnement extracellulaire, car ces récepteurs «regardent généralement» des cellules.
Les sites avec la concentration de glutamate la plus élevée sont des terminaux nerveux, cependant, leur distribution est conditionnée par les besoins énergétiques des cellules à travers le corps.
Selon le type de cellule, lorsque l'acide glutamique y entre, il peut être dirigé vers les mitochondries, à des fins énergétiques, ou peut être redistribuée vers des vésicules synaptiques et les deux processus utilisent des systèmes de transport intracellulaire spécifiques.
Structure
L'acide glutamique, comme le reste des acides aminés, est un acide α-aminé qui a un atome de carbone central (qui est chiral), du carbone α, que quatre autres groupes se joignent: un groupe carboxyle, un groupe amino, un groupe amino, un Atome d'hydrogène et groupe de substitut (chaîne latérale ou groupe R).
Le groupe R de l'acide glutamique donne à la molécule un deuxième groupe carboxyle (-COH) et sa structure est -ch2-Ch2-COOH (-ch2-ch2-coo- sous sa forme ionisée), donc la somme du carbone total des atomes de la molécule est cinq.
Cet acide aminé a une masse relative de 147 g / mol et la constante de dissociation (PKA) de son groupe R est 4.25. A un point isoélectrique de 3.22 et l'indice de présence des protéines moyens est d'environ 7%.
Depuis un pH neutre (environ 7), l'acide glutamique est ionisé et a une charge négative, est classé dans le groupe d'acides aminés polaires à charge négative, un groupe dans lequel l'acide aspartique est également inclus (aspartate, sous sa forme ionisée).
Les fonctions
L'acide glutamique ou sa forme ionisée, le glutamate, a de multiples fonctions, non seulement du point de vue physiologique, mais aussi du point de vue industriel, clinique et gastronomique.
Peut vous servir: Acide lipoïque alpha: fonction, propriétés, avantages, contre-indicationsFonctions physiologiques de l'acide glutamique
L'une des fonctions physiologiques les plus populaires de l'acide glutamique dans le corps de la plupart des vertébrés est leur participation en tant que neurotransmetteur excitateur dans le cerveau. Il a été déterminé que plus de 80% des synapses excitatrices communiquent en utilisant du glutamate ou de l'un de ses dérivés.
Parmi les fonctions que les synapses qui utilisent cet acide aminé ont pendant la signalisation sont la reconnaissance, l'apprentissage, la mémoire et autres.
Le glutamate est également lié au développement du système nerveux, à l'initiation et à l'élimination des synapses et de la migration, de la différenciation et de la mort cellulaire. Il est important pour la communication entre les organes périphériques tels que les voies alimentaires, le pancréas et les os.
De plus, le glutamate a des fonctions à la fois dans les processus de synthèse des protéines et des peptides, et dans la synthèse des acides gras, dans la régulation des niveaux cellulaires d'azote et du contrôle de l'équilibre anionique et osmotique.
Il sert de précurseur pour différents intermédiaires du cycle d'acide tricarboxylique (cycle Krebs) et également d'autres neurotransmetteurs tels que GABA (acide gamma aminobutyrique). À son tour, il s'agit d'un précurseur dans la synthèse d'autres acides aminés tels que la L-Proline, la L-arginine et la L-Alanina.
Applications cliniques
Différentes approches pharmaceutiques sont principalement basées sur les récepteurs d'acide glutamique tels que les cibles thérapeutiques pour le traitement des maladies psychiatriques et d'autres pathologies liées à la mémoire.
Le glutamate a également été utilisé comme agent actif dans différentes formulations pharmacologiques conçues pour traiter les infarctus du myocarde et la dyspepsie fonctionnelle (problèmes gastriques ou d'indigestion).
Applications d'acide glutamique industrielles
L'acide glutamique et ses dérivés ont diverses applications dans différentes industries. Par exemple, le sel monosodique du glutamate est utilisé dans l'industrie alimentaire comme condiment.
Cet acide aminé est également le matériau de départ de la synthèse d'autres produits chimiques et le polyccide glutamique est un polymère anionique naturel biodégradable, comestible et non toxique pour l'homme ou pour l'environnement.
Dans l'industrie alimentaire, il est également utilisé comme épaississant et comme agent de «soulagement» de l'amertume de différents aliments.
Il est également utilisé comme cryoprotecteur, comme un adhésif biologique "curable", comme transporteur de médicaments, pour la conception de fibres et d'hydrogels biodégradables capables d'absorber de grandes quantités d'eau, entre autres.
Biosynthèse
Tous les acides aminés dérivent des intermédiaires glycolytiques, du cycle de Krebs ou de la route du phosphate de pentose. Le glutamate est spécifiquement.
La voie biosynthétique de cet acide aminé est assez simple et ses pas sont dans presque tous les organismes vivants.
Métabolisme du glutamate et de l'azote
Dans le métabolisme de l'azote, c'est par glutamate et glutamine que l'ammonium est incorporé dans les différentes biomolécules du corps et, par des réactions de transamination, le glutamate fournit les groupes amino de la plupart des acides aminés.
Ainsi, cette voie implique l'assimilation des ions ammonium aux molécules de glutamate, qui se déroule en deux réactions.
La première étape de l'itinéraire est catalysée par une enzyme connue sous le nom de glutamine de synthétase, qui est présente dans pratiquement tous les organismes et participe à la réduction du glutamate et de l'ammonium pour produire de la glutamine.
Dans les bactéries et les plantes, en revanche, le glutamate est produit à partir de glutamine par enzyme connue sous le nom de glutamate de synthase.
Chez les animaux, cela est produit à partir de la transamination du α-zétoglutarate, qui se déroule pendant le catabolisme des acides aminés. Sa principale fonction chez les mammifères est de convertir l'ammonium libre toxique en glutamine, qui est transporté par le sang.
Il peut vous servir: embryologie: histoire, domaine d'étude et branchesDans la réaction catalysée par l'enzyme glutamate synthase, l'α-cétoglutarate passe par un processus d'amination réducteur, où la glutamine participe en tant que donneur du groupe d'azote.
Bien qu'il se produise en beaucoup moins de proportion, chez les animaux, le glutamate est également produit par la réaction d'une seule étape entre α-zotoglutarate et ammonium (NH4), qui est catalysé par l'enzyme L-glutamate déshydrogénase, virtuellement omniprésent dans tous les organismes vivants.
Cette enzyme est associée à la matrice mitochondriale et à la réaction que les catalyses peuvent être écrites plus ou moins comme suit, où NADPH travaille dans la réduction de la puissance:
α-cétoglutarate + NH4 + NADPH → L-glutamate + NADP (+) + eau
Métabolisme et dégradation
L'acide glutamique est utilisé par les cellules du corps pour servir différentes fins, parmi lesquelles la synthèse des protéines, le métabolisme énergétique, la fixation d'ammonium ou la neurotransmission se distinguent.
Le glutamate tiré du milieu extracellulaire dans certains types de cellules nerveuses peut être "recyclé" lorsqu'il est transformé en glutamine, qui est libéré aux liquides extracellulaires et pris par les neurones à transformer à nouveau en glutamate, qui est connu sous le nom de cycle Glutamine-glutamate.
Une fois ingéré avec des aliments alimentaires, l'absorption intestinale de l'acide glutamique se termine généralement par sa transformation en autres acides aminés tels que l'alanine, un processus médié par les cellules de la muqueuse intestinale, qui l'utilise également comme source d'énergie.
Le foie, en revanche, est responsable de devenir du glucose et du lactate, dont l'énergie chimique est principalement en forme d'ATP.
L'existence de diverses enzymes métabolisantes de glutamate dans différents organismes a été signalée, telle est le cas du glutamate déshydrogène, des liasases et des glutaminases glutamate-ammonium et beaucoup d'entre eux ont été impliqués dans la maladie d'Alzheimer.
Aliments riches en acide glutamique
L'acide glutamique est présent dans la plupart des aliments consommés par l'homme et certains auteurs affirment que pour un être humain de 70 kg, l'apport quotidien d'acide glutamique dérivé du régime est d'environ 28 g.
Parmi les aliments les plus riches de cet acide aminé figurent ceux d'origine animale, où les viandes (bovine, porc, mouton, etc.), Œufs, produits laitiers et poissons. Les aliments d'origine végétale riches en glutamate sont des graines, des grains, des asperges et d'autres.
En plus des différents types d'aliments naturellement riches dans cet acide aminé, un dérivé de celui-ci, le sel monosodique du glutamate est utilisé comme additif pour améliorer ou augmenter le goût de nombreux plats et aliments transformés industriels.
Avantages de votre apport
Le glutamate ajouté à différentes préparations culinaires aide à "induire" la saveur et à améliorer la sensation de goût dans la cavité buccale, qui a apparemment des significations physiologiques et nutritionnelles importantes.
Des essais cliniques ont montré que la consommation d'acide glutamique a des applications potentielles dans le traitement des «troubles» ou des pathologies orales liées au goût et à «l'hyposalivation» (production à faible salive))).
De même, l'acide glutamique (glutamate) est un nutriment d'une grande importance pour le maintien de l'activité cellulaire normale dans la muqueuse intestinale.
Il a été démontré que l'approvisionnement de cet acide aminé aux rats qui ont subi des traitements chimiothérapeutiques augmentent les caractéristiques immunologiques de l'intestin, en plus de maintenir et d'améliorer l'activité et les fonctions de la muqueuse intestinale.
Au Japon, en revanche, les régimes médicaux ont été conçus sur la base d'aliments riches en acide glutamique pour les patients qui subissent.
Peut vous servir: troponine: caractéristiques, structure, fonctions et testsCet acide aminé est également utilisé pour induire l'appétit chez les patients âgés atteints de gastrite chronique qui sont normalement inappropriées.
Enfin, des études liées à l'approvisionnement oral en acide glutamique et en arginine suggèrent qu'ils sont impliqués dans la régulation positive des gènes liés à l'adipogenèse dans le tissu musculaire et à la lipolyse dans les tissus adipeux.
Troubles de la carence
Étant donné que l'acide glutamique sert de précurseur dans la synthèse de divers types de molécules tels que les acides aminés et d'autres neurotransmetteurs, les défauts génétiques associés à l'expression des enzymes liées à leur biosynthèse et leur recyclage peuvent avoir des conséquences pour la santé de l'organisme de tout animal.
Par exemple, l'enzyme de l'acide glutamique discarboxylase est en charge de la conversion du glutamate en acide gamma aminobutyrique (GABA) un neurotransmetteur essentiel pour les réactions nerveuses inhibiteurs.
Par conséquent, l'équilibre entre l'acide glutamique et le GABA est de la plus haute importance pour maintenir le contrôle de l'excitabilité corticale, car le glutamate fonctionne principalement dans les synapses nerveuses excitantes.
À son tour, puisque le glutamate est impliqué dans une série de fonctions cérébrales telles que l'apprentissage et la mémoire, sa carence pourrait provoquer des défauts dans ces classes de processus cognitifs qui le nécessitent en tant que neurotransmetteur.
Les références
- Ariyoshi, m., Katane, m., HAMEIS, K., Miyoshi, et., Nakane, M., Hoshino, un.,… Matoba, s. (2017). Le d-glutamate est métabolisé dans le cœur Mithochondria. Rapports scientifiques, 7(Août 2016), 1-9. https: // doi.org / 10.1038 / SREP43911
- Barret, G. (1985). Chimie et biochimie de l'acide aminé. New York: Chapman et Hall.
- Danbolt, n. C. (2001). Absorption du glutamate. Progrès en neurobiologie, 65, 1-105.
- Fonnum, F. (1984). Glutamate: un neurotransmetteur dans le cerveau des mammifères. Journal de neurochimie, 18(1), 27-33.
- Gratini, s. (2000). Symposium international sur le glutamate. Acide glutamique, vingt ans plus tard.
- Graham, t. ET., Sgro, V., Frères, D., & Gibala, m. J. (2000). Ingestion de glutamate: les bassins d'acides aminés plasma et musculaire des humains au repos. Journal américain de physiologie - endocrinologie et métabolisme, 278, 83-89.
- Hu, C. J., Jiang, Q. ET., Zhang, t., Yin, et. L., Li, F. N., Votre, J. ET.,... Kong, x. F. (2017). La supplémentation alimentaire avec de l'arginine et de l'acide glutamique améliore l'expression des gènes lipogéniques clés chez les porcs en croissance. Journal of Animal Science, 95(12), 5507-5515.
- Johnson, J. L. (1972). L'acide glutamique comme émetteur synaptique dans le système nerveux. Une critique. Recherche cérébrale, 37, 1-19.
- Kumar, R., Vikramachakravarthi, D., & Pal, P. (2014). Production et purification de l'acide glutamique: une revue critique vers l'intention du processus. Génie chimique et traitement: intensification du processus, 81, 59-71.
- Mourtzakis, m., & Graham, t. ET. (2002). L'ingestion de glutamate et ses effets au repos et pendant l'exercice chez l'homme. Journal of Applied Physiology, 93(4), 1251-1259.
- Neil, E. (2010). Processus biologiques pour la production d'hydrogène. Progrès en génie biochimique / biotechnologie, 123(Juillet 2015), 127-141. https: // doi.org / 10.1007/10
- Okumoto, s., Funck, D., Trovato, m., & Forlani, G. (2016). Acides aminino de la famille du glutamate: fonctions au-delà du métabolisme primaire. Frontières en science des plantes, 7, 1-3.
- Olubodun, J. SOIT., Zulkifli, je., Farjam, un. S., Hair-Bejo, m., & Kasim, un. (2015). La supplémentation en acide gutamine et glutamique améliore les performances des poulets de chair dans une condition tropicale chaude et humide. Journal italien de science animale, 14(1), 25-29.
- Umbarger, H. (1978). Biosynthèse des acides aminés et sa régulation. Ann. Tour. Biochimie., 47, 533-606.
- Waelsch, h. (1951). Acide glutamique et fonction cérébrale. Progrès en chimie des protéines, 6, 299-341.
- Yelamanchi, s. D., Jayaram, s., Thomas, J. K., Gundimeda, s., Khan, un. POUR., Singhal, un.,... Gowda, H. (2015). Une carte de voie du métabolisme du glutamate. Journal of Cell Communication and Signaling, dix(1), 69-75.
- « Caractéristiques, structure, fonctions d'Alanina, biosynthèse
- Caractéristiques d'asparagine, structure, fonctions, biosynthèse »

