Caractéristiques d'asparagine, structure, fonctions, biosynthèse
- 4854
- 89
- Paul Dumas
La Asparagine (ASN ou N) est un acide aminé important pour la signalisation cellulaire et l'union entre les protéines et les glucides. Ceci est l'un des 22 acides aminés de base et est catalogué comme non essentiel, car il est synthétisé par le corps des mammifères.
Cet acide aminé est classé dans le groupe d'acides aminés polaires sans charge et a été le premier acide aminé nu, un fait qui s'est produit en 1806, où il a été isolé du jus d'asperges (une sorte de plante herbacée) par les produits chimiques français Vauquelin et Robiquet.
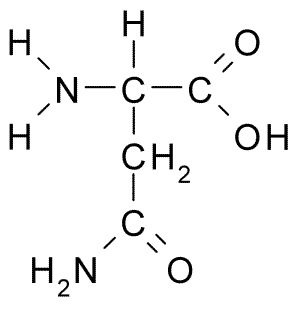
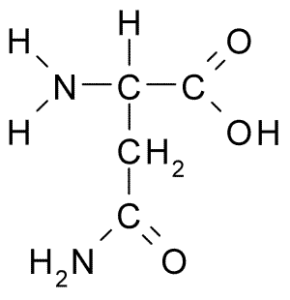 Structure chimique de l'asparagine d'acide aminé (source: borb, via Wikimedia Commons)
Structure chimique de l'asparagine d'acide aminé (source: borb, via Wikimedia Commons) Malgré sa découverte précoce, le rôle biologique et nutritionnel de l'asparagine n'a pas été reconnu mais plus de 100 ans plus tard lorsque, en 1932, sa présence dans la structure d'une protéine présente dans les graines de chanvre a été confirmée.
L'asparagine et la glutamine servent de substrats pour les groupes au milieu de deux acides aminés très fréquents dans les protéines: aspartique (acide aspartique) et glutamate (acide glutamique), respectivement. L'asparagine et la glutamine sont facilement hydrolysées dans ces acides aminés par action enzymatique ou acide et composés de base.
De nombreuses enzymes de protéase sérine qui sont responsables de l'hydrolyzage des liaisons peptidiques ont une asparagine dans la chaîne latérale de leur site actif. Ce résidu a une charge partielle négative et est chargé de se joindre à une manière complémentaire avec la charge positive des peptides blancs, à l'approche du site de coupe.
L'enzyme en charge de la synthèse oxalacétate à partir d'asparagine est utilisée dans les traitements chimiothérapeutiques et est connue sous le nom de L-Asparaginase, qui est responsable du catalyse de la fragmentation hydrolytique de l'amida d'asparagine à l'aspartate et à l'ammonium.
L'asparaginase est surexprimée et purifiée à partir de Escherichia coli, À injecter chez les patients d'enfants qui ont une leucémie lymphoblastique aiguë, car les lymphocytes normaux et malins dépendent de la capture de l'asparagine dans le sang pour la croissance et la multiplication.
[TOC]
Caractéristiques et structure
Toutes les structures chimiques des acides aminés ont un groupe carboxyle (-CoH), un groupe amino (-NH3 +), un hydrogène (-H) et un groupe R ou substituant qui sont unis par le même atome de carbone central, connu sous le nom de carbone α.
Les acides aminés diffèrent les uns des autres par l'identité de leurs chaînes latérales, qui sont celles qui sont appelées groupes R et qui peuvent varier en taille, structure, groupes fonctionnels et même charge électrique.
Les atomes de carbone des groupes R s'identifient aux lettres de l'alphabet grec. Ainsi, dans le cas de l'asparagine, les carbones de la chaîne R sont identifiés comme des carbones β et γ.
Peut vous servir: Agar XLD: fondation, préparation et utilisationsSelon un autre type de nomenclatures, l'atome de carbone dans le groupe carboxyle (-COH) est répertorié comme C-1, donc, continuant avec la numérotation, le carbone α serait C-2 et ainsi de suite.
Une molécule d'asparagine a quatre atomes de carbone, y compris le carbone α, le carbone du groupe carboxyle et deux atomes de carbone qui font partie du groupe R, connu sous le nom de carboxamide (-ch2-co-co-nh2).
Ce groupe carboxamide ne se trouve que dans deux acides aminés: dans l'asparagine et la glutamine. Il a la caractéristique qu'il peut former des ponts d'hydrogène avec une grande facilité à travers le groupe amino (-NH2) et le groupe carbonyle (-co).
Classification
L'asparagine appartient au groupe d'acides aminés polaires sans charge, qui sont des acides aminés très solubles dans l'eau et très hydrophiles (en raison de leur capacité de formation de plusieurs ponts d'hydrogène).
Dans le groupe d'acides aminés polaires sans charge, se trouvent également la sérine, la treonine, la cystéine et la glutamine. Tous ce sont des composés "Zwitterionics», Puisqu'ils ont un groupe polaire dans sa chaîne R qui contribue à la neutralisation des charges.
Tous les acides aminés polaires sans charge ne sont pas ionisables en pH près de 7 (neutre), c'est-à-dire qu'ils n'ont pas de charges positives ou négatives. Cependant, dans les milieux acides et de base, les substituants sont ionisés et acquièrent un fardeau.
Stéréochimie
Le carbone central ou le carbone α des acides aminés est un carbone chiral, puis il a quatre substituants unis différents, ce qui provoque au moins deux stéréoisomères distinctibles pour chaque acide aminé.
Les stéréoisomères sont des images spéculaires d'une molécule qui ont la même formule moléculaire, mais ne sont pas superponables les unes avec les autres, comme les mains (gauche et droite). Ils sont indiqués avec la lettre D ou L, car expérimentalement les solutions de ces acides aminés font tourner le plan de lumière polarisé dans des directions opposées.
L'asymétrie générale des acides aminés rend la stéréochimie de ces composés d'une grande importance, car chacune a des propriétés différentes, est synthétisée et participe à différentes routes métaboliques.
L'asparagine peut être trouvée sous la forme d-asparagine ou l-asparagine, ce dernier étant le plus fréquent dans la nature. Il est synthétisé par la l-synthésase et métabolisé pour la L-asparaginase, les deux enzymes sont très abondantes dans le foie des vertébrés.
Les fonctions
La facilité de formation des ponts d'hydrogène d'asparagine en fait un acide aminé crucial pour la stabilité structurelle des protéines, car il peut former des ponts d'hydrogène internes avec les chaînes latérales des autres acides aminés qui les inventent.
Peut vous servir: 25 exemples de reproduction asexuéeL'asparagine se trouve généralement à la surface des milieux aqueux typiques, stabilisant leur structure.
De nombreuses glycoprotéines peuvent se lier aux glucides ou aux glucides à travers un résidu d'asparagine, de tréonine ou de sérine. Dans le cas de l'asparagine, une acétyl galactosamine est généralement jointe au groupe amino par n-glycycosylation.
Il est important de souligner que dans toutes les glycosylées de N-glycosylées, les glucides se lient à ceux-ci à travers un résidu d'asparagine qui est dans une région spécifique désignée comme asn-x-ser / thr, où x est tout acide aminé.
Ces glycoprotéines sont assemblées dans le réticulum endoplasmique, où elles sont glycosylées telles qu'elles sont traduites.
Biosynthèse
Tous les organismes eucaryotes assimilent l'ammoniac et le transforment en glutamate, glutamine, carbamil-phosphate et asparagine. L'asparagine peut être synthétisée à partir d'intermédiaires glycolytiques, dans le cycle de l'acide citrique (de l'oxalacétate) ou des précurseurs consommés dans le régime alimentaire.
L'enzyme d'asparagine de synthétase est une amidotransférase dépendante de la glutamine et de l'ATP que l'ATP et le pyrophosphate inorganique (PPI) crachent et utilisent l'ammoniac ou la glutamine pour catalyser une réaction d'amidation et convertir l'aspartate en asparagine.
Les bactéries et les animaux ont une asparagine de synthétase, cependant, dans les bactéries, l'enzyme utilise l'ion ammonium comme donneur d'azote, tandis que chez les mammifères, la synthética synthésase utilise la glutamine comme principal donneur du groupe d'azote.
La rupture enzymatique de l'ATP en AMP et le pyrophosphate inorganique (IPP), ainsi que la glutamine en tant que donneur du groupe Amida, sont les principales différences en ce qui concerne la biosynthèse de la L-glutamine entre les différents organismes.
Dégradation
La plupart des études sur le métabolisme d'asparagine ont été menées dans les plantes, compte tenu du fait que les études initialement chez les mammifères ont été entravées par le manque de méthodologies suffisamment sensibles pour les tests d'acides aminés au niveau de systèmes plus complexes.
La L-asparagine est constamment hydrolysée chez les mammifères par la L-asparaginase pour provoquer l'acide aspartique et l'ammonium. Il est utilisé pour la synthèse des glycoprotéines et est l'un des principaux précurseurs de l'oxalacétate pour le cycle de l'acide citrique.
L'enzyme de l'asparaginase catalyse l'hydrolyse de l'asparagine à aspartate, par la suite l'aspartate est transaminé avec α-cetroglutarate pour produire du glutamate et de l'oxalacétate.
Peut vous servir: épiblasteSyntheta asparagine, également connue sous le nom d'aspartate-amoniaco ligase, se trouve abondamment de cellules cérébrales de mammifères.
Lorsque de faibles niveaux de cette enzyme sont perçus dans le corps, ce que l'on appelle des «aminés aminoacidopathies», alors que les substrats précurseurs s'accumulent dans le cytoplasme des cellules cérébrales.
Aliments riches en asparagine
Les personnes qui ont une leucémie lymphoblastique aiguë ont généralement des carences en ce qui concerne l'enzyme d'asparagine synthétase et dépendent de l'asparagine dans la circulation, ils sont donc recommandés d'un régime dans des aliments riches en asparagine ou de l'approvisionnement exogène de la même chose.
Parmi les multiples aliments avec une teneur élevée en asparagine figurent-elle.
Il existe des concentrés de L-Asparagine qui sont formulés pour les athlètes à haute compétition, car leur consommation aide à régénérer les protéines qui composent les tissus.
De plus, les personnes qui ont un déficit dans la synthèse des acides aminés ingèrent également ces comprimés pour éviter les troubles de leur système nerveux central.
L'asparagine est plus facile à métaboliser grâce à sa forme en L-Asparagine, car de nombreuses enzymes impliquées dans leur métabolisme ne reconnaissent pas la forme D-Asparagine et, par conséquent, toutes les asparagines ingérées dans les aliments sont disponibles pour différents processus d'organisme.
L'apport abondant d'asparagine peut être bénéfique, cependant, il est recommandé de ne pas.
Les références
- Cooney, D. POUR., Capizzi, R. L., & Handschumacher, R. ET. (1970). Évaluation du métabolisme de la L-Asparagine dans les animes et l'homme. Recherche contre le cancer, 30 (4), 929-935
- Dunlop, P. C., Roon, R. J., & Même, h. L. (1976). Utilisation de la D-asparagine par Saccharomyces cerevisiae. Journal of Bactériologie, 125 (3), 999-1004.
- Kambhampati, s., Ajewole, e., & Marsolais, F. (2017). Progrès du métabolisme d'asparagine. Dans Progrès en botanique Vol. 79 (pp. 49-74). Springer, Cham.
- Kornfeld, R., & Kornfeld, s. (1985). Assemblage d'oligosaccharides liés à l'asparagine. Revue annuelle de la biochimie, 54 (1), 631-664
- Mathews, C. K., & Ahern, k. g. (2002). Biochimie. Pearson Education.
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.
- Yamada, k., Hashizume, D., Shimizu, t., & Yokoyama, s. (2007). L-asparagine. Acte cristallographique Section E: Rapports de structure en ligne, 63 (9), 3802-3803.
- « Caractéristiques de l'acide glutamique, fonctions, biosynthèse
- Caractéristiques des mains, structure, fonctions »

