Acide phosphoreux (H3PO3)
- 1611
- 314
- Raphaël Charles
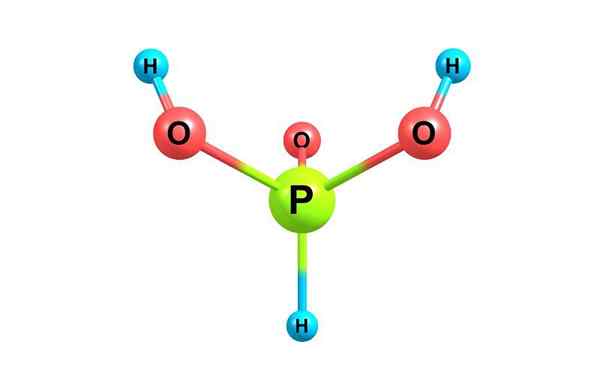
 Structure chimique de l'acide phosphoreux. Avec licence
Structure chimique de l'acide phosphoreux. Avec licence Qu'est-ce que l'acide phosphoreux?
Il acide phosphoreux, Également appelée acide orthophosphant, c'est un composé chimique de la formule H3Pote3. C'est l'un des divers acides oxygénés du phosphore et sa structure est présentée dans l'image supérieure.
Compte tenu de la formule composée, cela peut être réécrit en tant que HPO (OH)2. Cette espèce existe en équilibre avec un tautomère mineur P (OH)3.
Les recommandations de l'IUPAC, 2005, sont que ce dernier est appelé acide phosphoreux, tandis que la forme de dihydroxy est appelée acide phosphonique. Seuls les composés de phosphore réduits sont des sorts avec une terminaison "ours".
L'acide phosphoreux est un acide diprotique, cela signifie qu'il n'a que la capacité de produire deux protons. C'est parce que le tautomère majoritaire est h3Pote3.
Lorsque cette forme perd un proton, la résonance stabilise les anions formés. P (OH) Tautoméro 3 n'a pas le bénéfice de la stabilisation de la résonance. Cela rend l'élimination du troisième proton beaucoup plus difficile.
Acide phosphorique (h3Pote3) Les ventes appelées phosphites, qui sont utilisées comme agents réducteurs. Il est préparé en dissolvant l'hexoxyde tétraphosphorique (P4SOIT6) Selon l'équation:
P4SOIT6 + 6 H₂o → 4 HPO (OH)2
Acide phosphoreux pur, h3Pote3, Il est mieux préparé par hydrolyse du trichlorure de phosphore, PCL3.
PCL3 + 3h2O → HPO (OH)2 + 3hcl
La solution résultante est chauffée pour expulser le HCl, et l'eau restante s'évapore jusqu'à ce qu'elle apparaisse 3Pote3 cristallin coloré lors du refroidissement. L'acide peut également être obtenu par action de l'eau sur PBR3 ou pi3.
Propriétés physiques et chimiques du acide phosphoreux
- L'acide phosphoreux est un cristal tétraédrique hygroscopique blanc ou jaune, avec un arôme similaire à l'ail.
Peut vous servir: solution insaturée- Le H3Pote3 Il a un poids moléculaire de 82,0 g / mol et une densité de 1 651 g / ml.
- Le composé a un point de fusion de 73 ° C et se décompose au-dessus de 200 ° C.
- Il est soluble dans l'eau, pouvoir dissoudre 310 grammes par 100 ml de ce solvant. Il est également soluble dans l'éthanol.
- C'est un acide fort avec une PKA entre 1,3 et 1,6.
- Le chauffage de l'acide phosphoreux à environ 200 ° C le fait de la disproportion sur l'acide phosphorique et la phosphine (pH3). La phosphine est un gaz qui s'allume normalement spontanément dans l'air.
4h3Pote3 + Chauffer → pH3 + 3h3Pote4
Réactivité et dangers
Réactivité
- L'acide phosphoreux n'est pas un composé stable.
- Absorber l'oxygène d'air pour former l'acide phosphorique.
- Former des dépôts jaunes en solution aqueuse qui sont spontanément inflammables lors du séchage.
- Réagir exothermiquement avec des bases chimiques (par exemple: amines et hydroxydes inorganiques) pour former des sels.
- Ces réactions peuvent générer des quantités dangereusement importantes de chaleur dans les petits espaces.
- Dissolution de l'eau ou dilution d'une solution concentrée avec de l'eau supplémentaire peut générer une chaleur significative.
- Réagit en présence d'humidité avec des métaux actifs, y compris des métaux structurels tels que l'aluminium et le fer, pour libérer de l'hydrogène, un gaz inflammable.
- Vous pouvez commencer la polymérisation de certains alcènes. Réagit avec les composés du cyanure pour libérer le cyanure d'hydrogène gazeux.
- Il peut générer des gaz inflammables et / ou toxiques en contact avec des ditiocarbamates, des isociens, des marchands, des nitrures, des nitriles, des sulfures et de forts agents réducteurs.
- Des réactions supplémentaires de génération de gaz sont produites avec des sulfites, des nitrites, des thiosulfates (pour donner des H2 et SO3), des dionitos (pour donner SO2) et des carbonates (pour donner du CO₂).
Il peut vous servir: einstenio (s): structure, propriétés, obtention, utilisationsDangers
- Le composé est corrosif pour les yeux et la peau.
- Le contact visuel peut entraîner des dommages cornéens ou une cécité.
- Le contact cutané peut produire une inflammation et des cloques.
- L'inhalation de poussière produira une irritation des voies gastro-intestinales ou respiratoires, caractérisées par des brûlures, des éternuements et une toux.
- Une surexposition sévère peut entraîner des dommages pulmonaires, une suffocation, une perte de connaissances ou une mort.
Action en cas de dommage
- Assurez-vous que le personnel médical est conscient des documents impliqués et prend des précautions pour se protéger.
- La victime doit être déplacée sur un nouveau site et appeler le service médical d'urgence.
- La respiration artificielle doit être donnée si la victime ne respire pas.
- La méthode bouche à bouche ne doit pas être utilisée si la victime a ingéré ou inhalé la substance.
- La respiration artificielle est effectuée à l'aide d'un masque de poche équipé d'une vanne unidirectionnelle ou d'un autre appareil respiratoire adéquat.
- L'oxygène doit être administré si la respiration est difficile.
- Les vêtements et chaussures contaminés doivent être retirés et isolés.
- En cas de contact avec la substance, rincez immédiatement la peau ou les yeux avec de l'eau courante pendant au moins 20 minutes.
- Pour un contact cutané inférieur, le matériau doit être évité sur la peau nonable.
- Gardez la victime calme et chaud.
- Les effets de l'exposition (inhalation, ingestion ou contact cutané) peuvent être retardés.
Utilisation de acide phosphoreux
- L'utilisation la plus importante de l'acide phosphore est la production de phosphites utilisés dans le traitement de l'eau. L'acide phosphorique est également utilisé pour préparer les sels de phosphite, comme le phosphite de potassium.
Peut vous servir: Boyle Law- Les phosphites ont démontré l'efficacité du contrôle d'une variété de plantes.
- En particulier, le traitement par injection de tronc ou de foliaire, qui contient des sels d'acide phosphoreux, est indiqué en réponse aux infections dues aux agents pathogènes des plantes de phytoftera et de type pythium (produire la décomposition de la racine).
- L'acide phosphoreux et les phosphites sont utilisés comme agents réducteurs dans l'analyse chimique. Une nouvelle synthèse pratique et évolutive des acides phénylacétiques, par la réduction catalysée par l'iodure d'acide mandélique, est basée sur la génération in-sitter d'acide iodéchique à partir de l'iodure de sodium catalytique. Pour cela, l'acide phosphorique est utilisé comme réducteur stoichiométrique.
- Il est utilisé comme ingrédient pour la production d'additifs utilisés dans l'industrie du poli (chlorure de vinyle). Les esters d'acide phosphoreux sont également utilisés dans plusieurs réactions de synthèse organique.
Les références
- Acide phosphoreux (H3PO3). Récupéré de Britannica.com.
- Acide musclé. Récupéré d'EBI.CA.ROYAUME-UNI.

