Structure chimique d'acide phosphatidique, biosynthèse, fonctions
- 5010
- 1076
- Lucas Schneider
Il acide phosphatidique ou phosphatider, Il s'agit d'un phospholipide appartenant à la famille des glycéophospholipides ou des phosphoglycérides, qui sont présents dans toutes les membranes biologiques. C'est le phospholipide le plus simple et fonctionne comme un précurseur à d'autres glycéophospholipides plus complexes, bien qu'il ne soit pas en grande quantité.
Dans ET. coli, Par exemple, il représente moins de 0.5% du total des phospholipides dans la membrane plasmique et changent rapidement en raison de son rôle d'intermédiaire biosynthétique.
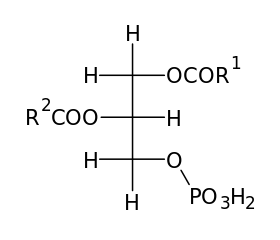
 Représentation de Fisher pour l'acide phosphatidique (Source: Mzaki [domaine public] via Wikimedia Commons)
Représentation de Fisher pour l'acide phosphatidique (Source: Mzaki [domaine public] via Wikimedia Commons) Ce phospholipide précurseur est formé par l'acilation des groupes hydroxyle de glycérol à 3-phosphate avec deux molécules d'acide gras activées et on pense qu'elle est présente pratiquement dans toutes les membranes biologiques.
La cardiolipine, un phospholipide important présent dans la membrane mitochondriale et la membrane plasmique des bactéries et.
L'acide losophosphatidique, c'est-à-dire une molécule d'acide phosphatidique qui manque un groupe acide, participe comme molécule intermédiaire dans de nombreux processus de signalisation extracellulaires.
[TOC]
Structure chimique
Comme la plupart des phospholipides, l'acide phosphatidique est une molécule amphipatique avec deux extrémités d'hydrophilicité opposée: une extrémité polaire hydropophile et des queues apolaires hydrophobes.
Comme mentionné ci-dessus, il s'agit du phospholipide le plus simple, car sa "tête" ou son groupe polaire n'est composée que du groupe phosphate qui est lié au carbone en position 3 d'une molécule de glycérol.
Ses queues apolaires sont formées par deux chaînes d'acides gras estérifiés en carbones des positions 1 et 2 du glycérol 3-phosphate. Ces acides gras ont des longueurs variables et des degrés de saturation.
Habituellement, la longueur des acides gras unis varie entre 16 et 24 atomes de carbone; Et il a été déterminé que les acides gras carbone à 2 attaches sont généralement insaturés (présence de liaisons à double carbone - carbone), bien que cela dépend de l'organisme qui est considéré, car dans les plastes végétaux, il s'agit d'un acide gras saturé saturé saturé saturé.
Peut vous servir: odoratBiosynthèse
La biosynthèse de l'acide phosphatidique est le point de branche de la synthèse des autres glycéophospholipides. Il commence par l'activation des acides gras par l'ajout d'une partie COA, une réaction catalysée par la synthétase acyl-CoA, qui produit l'acyl-CoA.
Il existe différentes isoformes de cette enzyme qui se trouvent dans le réticulum endoplasmique et dans les mitochondries, mais les réactions se produisent très similaires à la façon dont elles sont données chez les procaryotes.
La première étape "engagée" de la route biosinthétique est celle du transfert de la molécule ACIL-COA vers le glycérol 3-phosphate, catalysée par une glycérol acyltransférase à 3-phosphate associée à la membrane externe de la mitochondrie et au réticulum endoplasmique.
Le produit de cette réaction, un acide lisse-sophathidique (comme il n'a qu'une seule chaîne d'hydrocarbures), on pense qu'il est transféré des mitochondries au réticulum endoplasmique afin d'effectuer la deuxième réaction de réaction d'acilation.
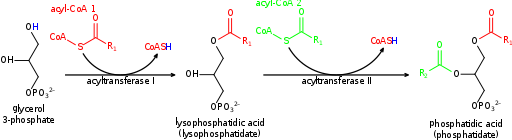 Résumé graphique de la synthèse de l'acide phosphatidique (Source: Krishnavedala [domaine public] via Wikimedia Commons)
Résumé graphique de la synthèse de l'acide phosphatidique (Source: Krishnavedala [domaine public] via Wikimedia Commons) L'enzyme qui catalyse cette étape est connue sous le nom de 1 acyltransférase à 1 acilglycérol 3-phosphate, abondante dans la membrane du réticulum endoplasmique et qui transfère spécifiquement les acides gras-phosphates à 3-acilglycérols de la molécule à 3-acilglycérol.
L'acide phosphatidique ainsi formé peut être hydrolysé par l'acide phosphatique phosphatase à 1,2-diacylglycérol, qui peut ensuite être utilisé pour la synthèse de la phosphatidylcholine et de la phosphatidylétalamine.
Autres chemins de production
Un autre itinéraire pour la production d'acide phosphatidique qui implique le «recyclage» des molécules de 1,2-diacylglycérol, a à voir avec la participation de kinases spécifiques aux enzymes qui transfèrent les groupes de phosphate de carbone en position 3 de la diiculglycéroll.
Peut vous servir: facteurs biotiques et abiotiques de la jungleUn autre provient de l'hydrolyse d'autres phospholipides, catalysés par des enzymes appelées phospholipases. Un exemple de ce processus est la production d'acide phosphatidique à partir du phosphatidylchol.
Biosynthèse dans les plantes
La production d'acide phosphatidique dans les plantes est associée à quatre compartiments différents des cellules végétales: plastes, réticulum endoplasmique, mitochondries et complexe de Golgi.
La première étape de l'itinéraire est la même que ce qui a été décrit précédemment, et dans chaque compartiment, un glycérol à 3-phosphate acyltransférase participe pour transférer le groupe acyl-CoA Carbon 1 activé d'une molécule de glycérol à 3-phosphate.
La synthèse est achevée par une enzyme appelée acycytransférase acide lisse acide après le transfert d'un autre groupe acide à la position C3 de l'acide lisse-sophospathidique.
Dans les plastes des plantes, cette enzyme transfère sélectivement les acides gras saturés d'une longueur correspondant à 16 atomes de carbone. Ceci est un attribut particulier des lipides synthétisés dans ces organites.
Les fonctions
L'acide phosphatidique est le phospholipide précurseur pour de nombreux phospholipides, galactolipides et triglycérides dans de nombreux organismes. Par conséquent, c'est une molécule essentielle pour les cellules, bien qu'elle ne remplisse pas les fonctions structurelles directes.
Chez les animaux, l'un des produits de son hydrolyse enzymatique, 1,2-diacylglycérol, est utilisé pour la formation de triacylglycérides ou de triglycérides par transcessterification avec une troisième molécule d'acide gras activé (associé à une partie COA)).
Les triglycérides sont des molécules de réserve d'énergie importantes pour les animaux, car l'oxydation des acides gras présents dans ces éléments conduit à la libération de grandes quantités d'énergie et de précurseurs et intermédiaires dans d'autres routes métaboliques.
Peut vous servir: capacités physiquesUn autre produit de son hydrolyse, de l'acide lisse -sophopathidique, est un deuxième messager significatif dans certaines voies de signalisation extracellulaires qui impliquent leur union aux récepteurs à la surface d'autres cellules impliquées dans la tumorogenèse, l'angiogenèse et les réponses immunitaires, entre autres.
Parmi ses fonctions en tant que molécule de signalisation, citons sa participation à l'induction de la prolifération cellulaire, une diminution de l'apoptose, une agrégation plaquettaire, une contraction des muscles lisses, une chimiotaxie, une invasion des cellules tumorales et d'autres.
Chez les bactéries, de l'acide phosphatidique est nécessaire lors d'un processus de changement de phospholipides membranaires qui fournit à la cellule des molécules "osmoprotectrices" appelées "oligosaccharides dérivés de la membrane".
Les références
- Koolman, J., & Roehm, k. (2005). Atlas de la couleur de la biochimie (2e éd.). New York, États-Unis: Thieme.
- Luckey, M. (2008). Biologie Membrane structurelle: avec des fondations biochimiques et biophysiques. la presse de l'Universite de Cambridge
- Mathews, C., Van Holde, K., & Ahern, k. (2000). Biochimie (3e érigé.). San Francisco, Californie: Pearson.
- Murray, R., Bender, D., Botham, K., Kennelly, P., Rodwell, V., & Weil, P. (2009). Biochimie illustrée de Harper (28e Ed.). McGraw-Hill Medical.
- Nelson, D. L., & Cox, M. M. (2009). Principes de lehninger de la biochimie. Éditions Omega (5e Ed.). https: // doi.org / 10.1007 / S13398-014-0173-7.2
- Rawn, J. D. (1998). Biochimie. Burlington, Massachusetts: Neil Patterson Publishers.
- Vance, J. ET., & Vance, D. ET. (2008). Biochimie des lipides, des lipoprotéines et des membranes. Dans Nouvelle compréhension Biochemistry Vol. 36 (4e ed.). Elsevier.
- « Structure de diiculglycérol, biosynthèse, fonctions
- Caractéristiques du contrat Comodato, éléments, exemples »

