Qu'est-ce que disulfuric ce qu'est la structure, les propriétés, les utilisations
- 4346
- 466
- Eva Henry
Qu'est-ce que l'acide disulfurique?
Il acide disulfurique C'est l'un des nombreux oxoacides de soufre, dont la formule chimique est H2S2SOIT7. La formule indique explicitement qu'il y a deux atomes de soufre, et comme son nom le souligne également, il doit y avoir deux molécules H2Swin4 seulement un; Cependant, il y a sept oxygène au lieu de huit, donc un soufre doit en avoir trois.
Cet acide est comme l'un des principaux composants de l'huile (ou de l'acide sulfurique fumée), qui devient une forme "dense" d'acide sulfurique. Telle est leur prédominance, que certains considèrent l'huile comme un synonyme de l'acide disulfurique; qui est également connu sous le nom traditionnel de l'acide pyrosulfurique.
Dans l'image, un receveur avec de l'huile est montré, avec une concentration de trioxyde de soufre, donc3, 20%. Cette substance est caractérisée par le fait d'être gras et incolore; Bien que jaunâtre ou brun puisse devenir jaune en fonction de la concentration du SO3 et de la présence de certaines impuretés.
Le ci-dessus raconte la participation du SO3 en h2S2SOIT7; c'est-à-dire une molécule H2Swin4 Réagir avec l'un de So3 Pour former de l'acide disulfurique. Être alors, h2S2SOIT7 Il peut également être écrit comme h2Swin4· SW3.
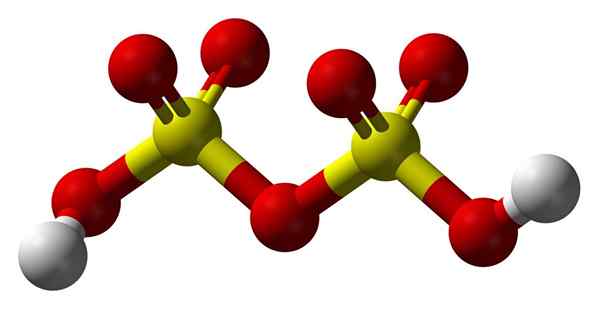
Structure d'acide disulfurique
 Structure d'acide disulfurique
Structure d'acide disulfurique En haut2S2SOIT7 Dans un modèle de sphères et de barres. Notez la symétrie de la molécule: le côté gauche du pont oxygène est identique à la droite. De ce point de vue, la structure peut être décrite avec la formule HO3Fade3H.
Aux deux extrémités se trouvent chaque groupe hydroxyle, dont l'hydrogène, par effet inductif de tous ces atomes d'oxygène, augmente sa charge partielle positive; Et par conséquent, l'acide disulfurique a encore une acidité plus forte que l'acide sulfurique.
Peut vous servir: hydroxyde de potassium: structure, propriétés, utilisationsLa molécule peut être écrite comme h2Swin4· SW3. Cependant, cela se réfère davantage à une composition de l'oléum qu'à la structure d'une molécule.
Cependant, si une molécule d'eau est ajoutée à H2S2SOIT7, Deux molécules H seront libérées2Swin4:
H2S2SOIT7 + H2Ou 2h2Swin4
L'équilibre peut se déplacer vers la gauche: à la formation de H2S2SOIT7 De h2Swin4 Si la chaleur est fournie. C'est pour cette raison que H2S2SOIT7 Il est également connu sous le nom d'acide pyrosulfurique; Puisqu'il peut être généré après le chauffage de l'acide sulfurique.
Aussi, comme mentionné au début, h2S2SOIT7 Il est formé par la combinaison directe de H2Swin4 Et ainsi3:
Swin3 + H2Swin4 H2S2SOIT7
Propriétés
 Oléum. Source: W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)], via Wikimedia Commons
Oléum. Source: W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)], via Wikimedia Commons Les propriétés de l'acide disulfurique ne sont pas très bien définies, car il est extrêmement difficile d'être isolé uniquement de l'huile.
Il faut se rappeler qu'il peut y avoir d'autres composés dans l'huile, avec H H2Swin4· XSO3, où en fonction de la valeur de x peut même avoir des structures polymères.
Une façon de le visualiser est d'imaginer que la structure supérieure de H2S2SOIT7 devient plus allongé par plus d'unités de SO3 et ponts à l'oxygène.
Dans un état presque pur, il se compose d'un solide cristallin (fumer) instable qui fond à 36 ° C. Cependant, ce point de fusion peut varier en fonction de la véritable composition.
L'acide disulfurique peut former ce que l'on appelle des sels disulfates (ou pyrosulfates). Par exemple, si vous réagissez avec l'hydroxyde de potassium, formez du pyrosulfate de potassium, k2S2SOIT7.
De plus, on peut dire qu'il a un poids moléculaire de 178 g / mol et deux équivalents acides (2 ions h+ qui peut être neutralisé avec une base forte).
Peut vous servir: volatilisationRéaction de déshydratation au sucre
Avec ce composé en forme d'huile, une réaction curieuse peut être effectuée: la transformation des morceaux de blocs de carbone.
Le H2S2SOIT7 Il réagit avec les sucres éliminant tous ses groupes OH sous forme d'eau, qui favorise les nouveaux syndicats parmi les atomes de carbone; des syndicats qui finissent par provoquer du charbon noir.
Nomenclature
L'acide disulfurique est considéré comme l'anhydride de l'acide sulfurique; C'est-à-dire qu'il perd un produit de molécule d'eau de condensation entre deux molécules acides. Avant tant de noms possibles pour ce composé, la nomenclature IUPAC recommande simplement celle de l'acide disulfurique.
Le terme «piro» fait allusion exclusivement à celui formé comme un produit de l'application de chaleur. IUPAC ne conseille pas ce nom pour H2S2SOIT7; Mais il est toujours actuellement utilisé par de nombreux chimistes.
La terminaison -ICO reste invariable puisque l'atome de soufre continue de maintenir une valence de +6. Par exemple, il peut être calculé par l'opération arithmétique suivante:
2h + 2s + 7o = 0
2 (+1) + 2s + 7 (-2) = 0
S = 6
Applications
Stocke l'acide sulfurique
L'acide disulfurique, étant donné sa propriété pour se solidifier en tant qu'huile, est capable de dissoudre et de stocker l'acide plus en toute sécurité sulfurique. C'est parce que le SO3 s'échappe de la création d'un «brouillard» irrasserable, qui est beaucoup plus soluble dans H2Swin4 que dans l'eau. Pour obtenir h2Swin4, Il serait suffisant pour ajouter à l'huile d'eau:
H2S2SOIT7 + H2Ou 2h2Swin4
Synthèse 100% d'acide sulfurique
De l'équation précédente, h2Swin4 Il est dilué dans l'eau ajoutée. Par exemple, si vous avez une solution aqueuse de H2Swin4, Où le SO3 Il a tendance à s'échapper et représente un risque pour les travailleurs, ajoutant de l'huile à la solution qui réagit avec l'eau formant plus d'acide sulfurique; c'est-à-dire augmenter sa concentration.
Il peut vous servir: impénétrabilité chimiqueS'il reste de l'eau, plus encore est ajouté3, qui réagit avec H2Swin4 pour produire plus d'acide ou d'huile disulfurique, puis il hydrate à nouveau "sécher" le H2Swin4. Le processus répète le parfois suffisamment pour obtenir de l'acide sulfurique à une concentration à 100%.
Un processus similaire est utilisé pour obtenir l'acide 100% nitrique. De même, il a été utilisé pour déshydrater d'autres substances chimiques, utilisées pour l'élaboration explosive.
Sulfonation
Structures, telles que les colorants; c'est-à-dire ajouter des groupes -3H, qui perd votre proton acide peut être ancré au polymère de fibre textile.
D'un autre côté, l'acidité de l'oléum est utilisée pour réaliser la deuxième nitration (ajouter des groupes -Un2) aux anneaux aromatiques.
Les références
- Chimie inorganique. (quatrième édition). Mc Graw Hill.
- Acide pyrosulfurique. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- « 20 inventions de la Renaissance qui ont changé le monde
- Tradual bactérien ce qui est, les caractéristiques et la préparation »

