Tradual bactérien ce qui est, les caractéristiques et la préparation
- 1410
- 235
- Adrien Remy
Il Frottis bactérien Il s'agit d'une extension sous la forme d'un film mince d'une suspension de micro-organismes bactériens fabriqués sur une plaque de verre ou une glissière transparente, pour l'observation sous un microscope optique.
L'extension sous la forme d'un film est réalisée afin de séparer autant que possible les micro-organismes, car si l'observation est regroupée n'est pas claire.
Dans l'étude des cultures bactériennes, des techniques de frottis, de fixation et de préparation de coloration sont utilisées pour mieux les analyser. En raison de la petite taille des micro-organismes, l'utilisation d'un microscope optique pour l'observation est nécessairement requise.
Les microscopes optiques sont des instruments indispensables pour l'observation du frottis. Ceux-ci utilisent des lentilles optiques et de la lumière permettant la visualisation des échantillons avec une grande augmentation de taille.
En général, les cellules vivantes n'ont pas de structures principalement colorées, les vues du microscope optique sont des échantillons incolores et transparents et montrent très peu de contraste interne et avec leur environnement.
L'observation avec le microscope optique simple de champ clair, sans utiliser de techniques de coloration auxiliaires, est très limitée et n'est utilisée que dans certains cas, comme dans l'observation du mouvement du micro-organisme.
Pour l'observation de micro-organismes de manière optimale, il est nécessaire d'obtenir un équilibre entre le contraste et la résolution. Les détails des cellules ne peuvent pas être observés au microscope, même avec une haute résolution; L'utilisation de colorants par le biais de techniques de coloration est nécessaire, ce qui contribue au contraste pour l'observation.
Caractéristiques d'un frottis bactérien de bonne qualité
Excellent contraste
Pour obtenir un excellent contraste, il y a des microscopes sophistiqués appelés Microscope à contraste de phase, interférence différentielle et microscope à champ sombre. Ce type de microscope est utilisé pour observer les structures bactériennes telles que les gousses et les filaments, entre autres.
La coloration est une technique simple pour augmenter le contraste qui est obtenu avec un microscope à champ clair. Dans cette technique, différents colorants peuvent être utilisés qui améliorent considérablement l'observation du microscope.
La coloration est effectuée directement sur les frottis ou les extensions des suspensions de micro-organismes sur les diapositives, précédemment séchées et fixes.
Bon fixe
La fixation est une technique utilisée pour préserver les structures cellulaires; provoque l'inactivation des micro-organismes et l'adhésion au verre de la diapositive. Il existe différents traitements de fixation: fixation thermique et fixation chimique.
Peut vous servir: acide palmitholéique: structure, fonctions, où est-ceFixation thermique
Il s'agit de la méthode la plus utilisée dans l'observation du frottis bactérien. La technique consiste à passer la suspension bactérienne en frottis par la flamme d'un briquet. Cette technique est capable de préserver la morphologie externe des bactéries, mais détruit ses structures internes.
Fixation chimique
La fixation chimique utilise des substances chimiques dans la conservation, comme le formaldéhyde ou le formol, l'éthanol et l'acide acétique, entre autres. L'avantage de l'utilisation d'agents chimiques de fixation est que la préservation des structures cellulaires internes des micro-organismes est obtenue.
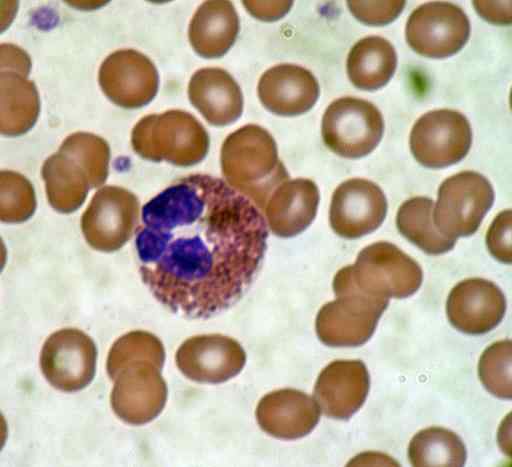
 Frottis de sang. Source: bobjgalindo [gfdl (http: // www.gnou.Org / copyleft / fdl.html) ou cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons
Frottis de sang. Source: bobjgalindo [gfdl (http: // www.gnou.Org / copyleft / fdl.html) ou cc by-sa 4.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)], de Wikimedia Commons Bonne coloration
Les procédures les plus courantes pour effectuer la coloration d'un frottis au séchage et fixe auparavant sont la coloration positive ou simple, la coloration différentielle et la coloration négative. Il existe également des techniques spéciales pour coller des structures cellulaires particulières (capsule, spores, flagelles).
Coloration positive ou coloration simple
La coloration positive ou simple est la technique de coloration la plus utilisée. Utilisez des colorants qui ont la capacité de rejoindre certaines structures microbiennes, leur permettant de les observer au microscope.
Ces colorants ont des groupes chromophores (partie colorée) dans leur structure chimique, avec des doubles liaisons alternatives et des liaisons simples (conjugaison). Ces liens peuvent à leur tour établir des liaisons ioniques ou covalentes avec certaines structures cellulaires.
Les colorants utilisés dans la coloration positive ou simple sont principalement des dérivés chimiques du aniline (sels biologiques colorés).
D'un autre côté, parmi les colorants, nous pouvons trouver certains avec un pH de base et d'autres avec un pH acide.
Colorants de base
Dans les colorants de base, le groupe chromophore a une charge électrique positive. La grande majorité des micro-organismes procaryotes ont un pH neutre interne, et leur surface cellulaire a une charge négative. Grâce à cette interaction électrostatique, le chromophore se lie à la cellule et à la teinture.
Des exemples de colorants de base sont le bleu de méthylène, le verre violet, le vert malachite, le fusible de base, la safranine, entre autres.
Colorants acides
Dans les colorants acides, le groupe chromophore a une charge électrique négative. Ceux-ci sont utilisés pour la coloration des protéines avec des groupes de charge positifs. Des exemples de colorants acides sont le fusible acide, la rose du Bengale, le rouge au Congo et l'éosine.
Il peut vous servir: Propage: ce que sont, les types et leurs caractéristiquesColoration différentielle
La technique de coloration différentielle consiste à appliquer deux colorants de couleur ou d'intensité différentes, pour distinguer le microscope au microscope. La coloration à gramme et la coloration à la résistance à l'alcool acide sont la coloration différentielle la plus utilisée en bactériologie.
La coloration de Gram est utilisée comme test préliminaire pour connaître la forme, la taille, le groupe cellulaire, en plus du type de paroi cellulaire. Par test de coloration à Gram, les bactéries de la paroi cellulaire sont classées comme bactéries gram positives et bactéries à Gram négatif.
Coloration négative
Dans cette technique, des colorants chimiques sont utilisés qui ne pénètrent pas à l'intérieur cellulaire, mais font que le milieu dans lequel les micro-organismes apparaissent comme un fond noir.
Dans la technique de coloration négative, le frottis est préparé avec une goutte de suspension à l'encre chinoise ou nigrosine, qui après avoir permis au séchage à température ambiante forme un film opaque au passage de la lumière. De cette façon, les micro-organismes sont observés comme des formes lumineuses sur un fond sombre.
préparation
POUR. Diffamer
1.- Lavez très bien les diapositives, séchez avec du papier absorbant et étiquetez-les. L'étiquette doit indiquer le contenu de la préparation, de la date et du nom de ceux qui l'ont traité.
2.- Allumez le briquet et stérilisez la poignée d'inoculation dans la flamme en rouge vivant.
3.- Laisser la poignée.
4.- Prenez le tube de culture bactérienne, retirez le capuchon et passez rapidement la bouche du tube près de la flamme plus légère (flamme).
5.- Entrez dans la poignée de l'inoculation dans le tube qui contient la culture bactérienne et prenez l'échantillon.
6.- Si la récolte est en liquide, placez l'échantillon prélevé avec la poignée au centre de la diapositive et étendez-la soigneusement dans un cercle d'environ 2 cm de diamètre.
7.- Stériliser la poignée de l'inoculation.
8.- Permettez le séchage du frottis dans l'air.
9.- Répétez les étapes de 3 à 8 trois fois.
dix.- Si la récolte est solide, une goutte d'eau distillée doit être précédemment placée sur la lame. Cela est fait pour mélanger un petit échantillon de la culture prélevée avec la poignée d'inoculation, selon les indications des étapes 2 à 5 (conditions de l'asepsie).
Il peut vous servir: Biologie du développement: histoire, quelles études, applicationsonze.- Étendre l'échantillon dilué avec la goutte d'eau sur la lame et répéter trois fois.
B. Fixation
1.- Ajouter aux enseignants secs sèches - Crop dans des gouttes de méthanol ou d'éthanol absolu.
2.- Laisser le séchage à l'air loin du briquet.
3.- Si le frottis provient d'une culture solide, la fixe de l'odeur sèche est faite de chaleur, la passant 2 à 3 fois rapidement.
4.- Appuyez sur le bas du frottis avec la partie dorsale de la main gauche (pour celles due à droite; sinon, utilisez la main droite) et vérifiez qu'il est froid.
C. Tachage simple
1.- Ajouter aux frottis 2 gouttes du colorant sélectionné et laissez agir pour le temps requis dans les protocoles spécifiques de chaque colorant (généralement entre 1 et 5 minutes).
2.- Certains colorants nécessitent une consommation de chaleur pour l'activation, auquel cas vous devez être très prudent lorsque vous chauffez les bagages dans la flamme du briquet (le manipuler avec des pincettes et éviter de bouillir). Une surchauffe du frottis peut détruire les cellules souhaitées.
3.- Retirez l'excès de lavage de colorant avec de l'eau distillée d'une image. Éliminez les eaux à laver, frappant doucement la diapositive pour sa chanson, inclinée sur la table de travail.
4.- Autoriser le séchage à l'air.
5.- Selon le type d'observation, une couverture est utilisée ou non à ce stade. La couverture et préserve le frottis. Si une observation de plongée à l'huile est effectuée à ce stade, le frottis n'est pas utilisé mais le frottis ne peut pas être préservé.
D. Préservation définitive du frottis
1.- Submerger le frottis successivement dans chacune des solutions indiquées ci-dessous, pendant un minimum de 5 minutes. Le but de ces "salles de bains" est de laisser le frottis complètement déshydraté. Chaque réactif doit être bien drainé, avant d'entrer dans le frottis dans la salle de bain suivante.
L'ordre des bains de déshydratation est le suivant:
- 70% d'éthanol
- À 95% d'éthanol
- Acétone pure
- Mélange d'acétone -xilol 1: 1
- Xilol
Puis autorise le séchage à l'air.
2.- Montez les couvertures, de préférence 22 × 22 mm, en utilisant le baume canadien ou d'autres moyens pour l'assemblage.
Les références
- Cappucino, J.g. et Welch, C.T. (2017). Microbiologie: un laboratoire manuel. Pearson.
- Holt, J.g. Éditeur. (1977). Le manuel de bactériologie déterminant de Bergey plus court. 8e Baltimore: The Williams and Wilkins Co.
- « Qu'est-ce que disulfuric ce qu'est la structure, les propriétés, les utilisations
- Quel est l'appareil psychique de Sigmund Freud? »

