Structure d'acide carbonique (H2CO3), propriétés, synthèse, utilisations

- 5117
- 72
- Lucas Schneider
Il acide carbonique C'est un composé inorganique, bien qu'il y ait ceux qui débattent qu'il est en fait organique, dont la formule chimique est H2CO3. C'est donc un acide diprotique, capable de donner deux ions H+ à l'environnement aqueux pour générer deux cations moléculaires H3SOIT+. De lui, les ions bicarbonate bien connus surgissent (HCO3-) et le carbonate (CO32-).
Cet acide particulier, simple, mais en même temps impliqué dans des systèmes où de nombreuses espèces participent à un équilibre de vapeur liquide, est formé à partir de deux molécules inorganiques fondamentales: l'eau et le dioxyde de carbone. La présence de CO2 Un non-lien est toujours observé qu'il y a une bulle dans l'eau, montant à la surface.
 Verre à eau gazifiée, l'une des boissons les plus courantes contenant de l'acide carbonique. Source: pxhere.
Verre à eau gazifiée, l'une des boissons les plus courantes contenant de l'acide carbonique. Source: pxhere. Ce phénomène est régulièrement observé dans les boissons gazeuses et l'eau gazeuse.
Dans le cas de l'eau gazeuse ou gazifiée (image supérieure), une telle quantité a été dissoute2 que votre pression de vapeur est plus d'une double pression atmosphérique. En le découvrant, la différence de pression à l'intérieur de la bouteille et l'extérieur diminue la solubilité du CO2, Alors les bulles qui finissent par échapper au liquide apparaissent.
Dans une moindre mesure, la même chose se produit dans n'importe quelle masse d'eau fraîche ou saline: lorsqu'ils les chaufferont, ils libéreront leur teneur en cotisation de CO2.
Cependant, le CO2 Il est non seulement dissous, mais subit des transformations dans sa molécule qui en font le H2CO3; Un acide qui a une très petite vie, mais suffisamment pour marquer un changement mésurable dans le pH de son environnement de solvant aqueux, et générer également un système de tampon de carbonate unique.
[TOC]
Structure
Molécule
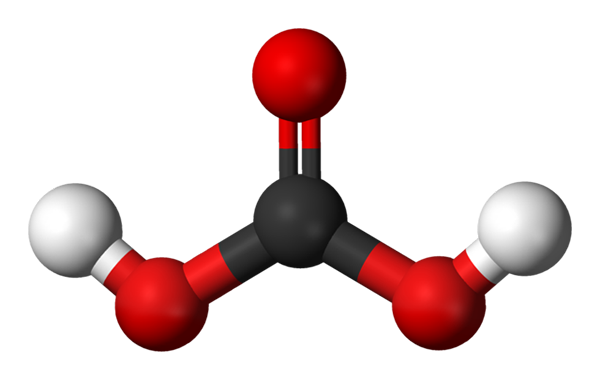 Molécule d'acide carbonique représentée avec un modèle de sphères et de barres. Source: Jynto et Ben Mills via Wikipedia.
Molécule d'acide carbonique représentée avec un modèle de sphères et de barres. Source: Jynto et Ben Mills via Wikipedia. Nous avons la molécule H2CO3, représenté avec des sphères et des barreaux. Les sphères rouges correspondent aux atomes d'oxygène, aux atomes noirs à carbone et aux atomes d'hydrogène blancs.
Notez qu'à partir de l'image, vous pouvez écrire une autre formule valide pour cet acide: CO (OH)2, où le CO devient le groupe carbonyle, C = O, lié à deux groupes hydroxyles, OH. Lorsqu'il y a deux groupes OH, capables de donner leurs atomes d'hydrogène, il est maintenant entendu d'où viennent les ions+ Sorti au milieu.
 Structure moléculaire de l'acide carbonique.
Structure moléculaire de l'acide carbonique. Notez que la formule Co (OH)2 Il peut être écrit comme ohcooh; c'est-à-dire du type rcooh, où r devient dans ce cas un groupe OH.
C'est pour cette raison, en plus du fait que la molécule se compose d'atomes d'oxygène, d'hydrogène et de carbone, trop courants dans la chimie organique, que l'acide carbonique est considéré par certains comme un composé organique. Cependant, dans la section de sa synthèse, il s'expliquera pourquoi les autres le considèrent de nature inorganique et non organisée.
Peut vous servir: dihydroxyacétone: structure, propriétés, obtention, utilisationsInteractions moléculaires
De la molécule h2CO3 On peut dire que sa géométrie est plate trigonale, avec le carbone situé au centre du triangle. Dans deux de ses sommets, il a les groupes OH, qui sont des donneurs de ponts d'hydrogène; Et dans les autres restants, un atome d'oxygène du groupe C = O, accepteur du pont hydrogène.
Ainsi, h2CO3 Il a une forte tendance à interagir avec les protiques ou les solvants oxygénés (et aussi l'azote).
Et par coïncidence, l'eau répond à ces deux caractéristiques, et l'affinité de H est tel2CO3 pour elle qui lui donne presque immédiatement un h+ Et un équilibre d'hydrolyse qui implique des espèces HCO commence à être établi3- et h3SOIT+.
C'est pourquoi la simple présence d'eau décompose l'acide carbonique et rend son isolation comme un composé pur trop compliqué.
Acide carbonique pur
Retour à la molécule H2CO3, Non seulement il est plat, capable d'établir des ponts d'hydrogène, mais il peut également présenter CIS-Trans Isomeía; C'est, dans l'image, nous avons l'isomère cis, avec les deux H pointant dans la même direction, tandis que dans l'isomère trans, ils pointeraient dans des directions opposées.
L'isomère cis est le plus stable des deux, et c'est pourquoi il est le seul à être représenté généralement.
Un solide pur de h2CO3 Il se compose d'une structure cristalline composée de couches ou de molécules de feuilles interagissant avec les ponts d'hydrogène latéraux. Ceci est attendu, étant la molécule H2CO3 Plat et triangulaire. Quand sublimal, les crépuscules cycliques apparaissent (h2CO3)2, qui sont rejoints par deux ponts d'hydrogène C = O - OH.
La symétrie des RH2CO3 Il n'a pas pu être défini par les moments. Il a été considéré comme cristallisé comme deux polymorphes: α-H2CO3 et β- h2CO3. Cependant, α-H2CO3, synthétisé sur la base d'un mélange de cho3Coh-co2, Il a été démontré que c'était en fait Cho3Oroh: une monométrie acide carbonique ster.
Propriétés
Il a été mentionné que H2CO3 C'est un acide diprotique, vous pouvez donc donner deux ions H+ à un médium qui les accepte. Lorsque ce milieu est de l'eau, les équations de sa dissociation ou de son hydrolyse sont:
H2CO3(AC) + H2Ou (l) HCO3-(AC) + H3SOIT+(AC) (KA1 = 2,5 × 10−4)
HCO3-(AC) + H2Ou (l) co32-(AC) + H3SOIT+(AC) (KA2 = 4,69 × 10−11)
Le HCO3- C'est l'anion bicarbonate ou hydrogénocarbonate, et le CO32- L'anion carbonate. Ils indiquent également leurs constantes d'équilibre respectives, KA1 et ka2. Être ka2 Cinq millions de fois plus petits que KA1, La formation et la concentration de CO32- Ils sont méprisables.
Donc, même s'il s'agit d'un acide diprotique, le second h+ Vous pouvez à peine le libérer appréciable. Cependant, la présence de CO2 dissous en grande quantité suffisamment pour acidifier le milieu; Dans ce cas, l'eau, abaissant ses valeurs de pH (en dessous de 7).
Peut vous servir: fusionParler d'acide carbonique se réfère pratiquement à une solution aqueuse où les espèces HCO prédominent3- et h3SOIT+; Il ne peut pas être isolé par des méthodes conventionnelles, car les moindres tentatives déplaceraient l'équilibre de la solubilité du CO2 à la formation de bulles qui échapperaient à l'eau.
La synthèse
Dissolution
L'acide carbonique est l'un des composés les plus faciles à synthétiser. Comme? La méthode la plus simple consiste à bouillonner, à l'aide d'une paille ou d'un sorbet, l'air que nous expirons dans un volume d'eau. Parce que nous expirons en essence co2, Cette bulle dans l'eau, dissolvant une petite fraction de la même.
Lorsque nous faisons cela, la réaction suivante se produit:
CO2(g) + h2Ou (l) h2CO3(AC)
Mais à son tour, la solubilité du CO doit être considérée2 dans l'eau:
CO2(g) CO2(AC)
Les deux CO2 comme H2Ou sont des molécules inorganiques, donc h2CO3 C'est inorganique depuis ce point vu.
Solde de vapeur liquide
En conséquence, nous avons un système en équilibre qui dépend considérablement des pressions partielles du CO2, ainsi que la température liquide.
Par exemple, si la pression du CO2 Il augmente (en cas de soufflage de l'air avec plus de force à travers le sorbet), plus de H se formera2CO3 et le pH deviendra plus acide; Depuis, le premier équilibre se déplace vers la droite.
D'un autre côté, si nous chauffons la dissolution de H2CO3, La solubilité du CO diminuera2 Dans l'eau parce que c'est un gaz, et l'équilibre se déplacera ensuite vers la gauche (il y aura moins de h2CO3). Similaire sera si nous essayons d'appliquer un vide: le CO2 Il s'échappera ainsi que les molécules d'eau, qui déplaceront à nouveau l'équilibre vers la gauche.
Solide pur
Ce qui précède permet de parvenir à une conclusion: à partir d'une solution de h2CO3 Il n'y a aucun moyen de synthétiser cet acide comme un solide pur à travers une méthode conventionnelle. Cependant, cela a été fait, depuis les années 90 du siècle dernier, à partir de mélanges solides de CO2 et h2SOIT.
À ce mélange solide co2-H2Ou à 50%, il est bombardé de protons (un type de rayonnement cosmique), de sorte qu'aucun des deux composants ne s'échappera et que la formation de H se produit2CO3. À cette fin, un mélange Cho a également été utilisé3Oh-co2 (Rappelez-vous α-H2CO3).
Une autre méthode consiste à faire de même mais directement en utilisant de la glace sèche, rien de plus.
Des trois méthodes Les scientifiques de la NASA pourraient parvenir à une conclusion: l'acide carbonique pur, solide ou gazeux, peut exister dans la crème glacée de Jupiter, dans les glaciers martiens, et dans les comètes, où de tels mélanges solides sont constamment irradiés pour les rayons cosmiques.
Peut vous servir: pipette volumétrique: caractéristiques, utilisations, étalonnage et erreursApplications
L'acide carbonique lui-même est un composé sans aucune utilité. De ses solutions, cependant, vous pouvez préparer des solutions d'amortissement basées sur les pairs HCO3-/CO32- ou h2CO3/ HCO3-.
Grâce à ces solutions et à l'action de l'enzyme de l'anhydrase carbonique, présente dans les globules rouges, le CO2 Produit dans la respiration peut être transporté dans le sang vers les poumons, où il est finalement libéré pour être expiré à l'extérieur de notre corps.
Le bubjueo du CO2 Il profite des boissons gazeinantes la sensation agréable et caractéristique qu'ils laissent dans leur gorge en les buvant.
Aussi, la présence de h2CO3 Il a une importance géologique dans la formation de stalactites calcaires, car elle les dissout lentement jusqu'à ce qu'ils soient à l'origine de leurs finitions pointues.
Et d'un autre côté, leurs solutions peuvent être utilisées pour préparer certains bicarbonates métalliques; Bien qu'il soit plus rentable et facile à utiliser un sel de bicarbonate (NAHCO3, par exemple).
Des risques
L'acide carbonique a une si petite vie dans des conditions normales (ils estiment qu'environ 300 nanosecondes), ce qui est pratiquement inoffensif pour l'environnement et les êtres vivants. Cependant, comme indiqué précédemment, cela n'implique pas qu'il ne peut pas générer un changement inquiétant dans le pH de l'eau de l'océan, affectant la faune marine.
D'un autre côté, le vrai "risque" est dans la consommation d'eau gazifiée, puisque la quantité de CO2 dissous en eux est beaucoup plus grand que dans l'eau normale. Cependant, et encore une fois, aucune étude n'a montré que la consommation d'eau gazifiée représente un risque mortel; Si vous le recommandez même pour jeûner et combattre l'indigestion.
Le seul effet négatif observé sur ceux qui boivent cette eau est la sensation de plénitude, car leurs estomacs sont remplis de gaz. De ceci (sans parler des boissons gazeuses, car elles sont composées de bien plus que d'acide carbonique), on peut dire que ce composé n'est pas du tout toxique.
Les références
- Jour, r., & Underwood, un. (1989). Chimie analytique quantitative (cinquième Ed.). Pearson Prentice Hall.
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Wikipédia. (2019). ACIDE CARBONIQUE. Récupéré de: dans.Wikipédia.org
- Danielle Reid. (2019). Acide carbonique: Formation, structure et équation chimique vidéo. Étude. Récupéré de: étudier.com
- Götz Bucher et Wolfram Sander. (2014). Clarifier la structure de l'acide carbonique. Vol. 346, numéro 6209, pp. 544-545. Doi: 10.1126 / science.1260117
- Lynn Yarris. (22 octobre 2014). Nouvelles idées sur l'acide carbonique dans l'eau. Laboratoire de Berkeley. Récupéré de: NewsCenter.LBL.Gouvernement
- Claudia Hammond. (14 septembre 2015). L'eau étincelante est-elle vraiment mauvaise pour vous? Récupéré de: BBC.com
- Jürgen Bernard. (2014). Acide carbonique solide et gazeux. Institut de chimie physique. Université d'Innsbruck.
- « Lois de transfert de chaleur, formes de transmission, exemples
- 15 avantages des pommes pour la santé physique et mentale »

