Cycopropan (C3H6)
- 4769
- 85
- Adrien Remy
Qu'est-ce que le cyclopropane?
Il Vélo C'est une molécule cyclique qui a la formule moléculaire C3H6, Et cela se compose de trois atomes de carbone unis sous la forme d'un anneau. En chimie, il existe une famille d'hydrocarbures saturés qui ont un squelette formé par des atomes de carbone unis par de simples liaisons en forme d'anneau.
Cette famille se compose d'un nombre varié de molécules (qui diffèrent de la longueur de sa chaîne carbonatée principale), et sont connues pour avoir des points de fusion et d'ébullition plus rapides que ceux des chaînes élevées, en plus d'une réactivité plus grande que celles-ci celles-ci.
Cycropotus a été découvert en 1881 par un chimiste autrichien appelé August Freund, qui était déterminé à savoir quel était l'élément toxique en éthylène et qui a pensé que c'était le même cyclopropane.
Même ainsi, ce n'est que dans les années 1930 qu'il a commencé à être produit au niveau industriel, quand ils ont découvert leurs utilisations comme anesthésie, car avant ce moment, ils n'étaient pas une attraction commerciale.
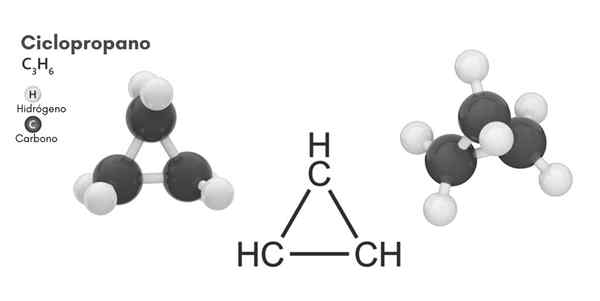
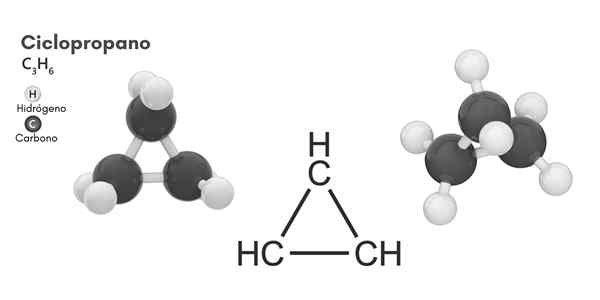
Structure chimique
 Structure moléculaire du cyclopropane
Structure moléculaire du cyclopropane Cyclisme, formule moléculaire C3H6, Il se compose de trois petits atomes de carbone qui se lient dans une configuration tels qu'un anneau se forme, laissant une symétrie moléculaire de D3h Dans chaque carbone de la chaîne.
La structure de cette molécule nécessite que les angles de liaison se forment à partir d'environ 60 °, beaucoup moins que ceux de 109,5 ° qui sont observés entre les atomes Hybrides SP3, qui est un angle plus stable thermodynamiquement.
Cela conduit à l'anneau souffrant d'une tension structurelle plus significative que les autres structures de ce type, en plus d'une tension de torsion naturelle qu'elle a par la conformation éclipsée de ses atomes d'hydrogène.
Peut vous servir: cinétique enzymatiquePour cette même raison, les liaisons formées entre les atomes de carbone dans cette molécule sont considérablement plus faibles que dans les alcanes communs.
D'une manière particulière et contrairement à d'autres liens où la proximité entre deux molécules symbolise une plus grande énergie de liaison, les liaisons entre les carbones de cette molécule ont une particularité d'avoir une longueur de moins que les autres alcanes (en raison de leur géométrie) et de la même chose temps ils sont plus faibles que les syndicats entre ceux.
De plus, le cyclopropane.
Propriétés du cyclo
Point d'ébullition
Par rapport aux autres cycloalcanos les plus courants, le cyclopropane.
D'un autre côté, par rapport au propane linéaire, le cyclopropane.
Point de fusion
Le point de fusion du cyclopropane est inférieur à celui des autres cycloalcanos, fondant à une température de 128 ºC inférieure à zéro. Même ainsi, ce n'est pas le seul cycloalcano qui fond à une température inférieure à zéro, pouvoir observer ce phénomène également dans le cyclobutane, le cyclopentano et le cycloheptane.
Ainsi, dans le cas du propane linéaire, il fond à une température inférieure à 187 ºC en dessous de zéro.
Densité
Le cycropane a la densité la plus élevée chez les cycloalcanos, étant plus de deux fois au cycle commun le plus dense (1 879 g / L pour le cyclopropane, dépassant le cyclodécano avec 0,871).
Peut vous servir: oxyde d'aluminium: structure, propriétés, utilisations, nomenclatureIl y a aussi une densité plus élevée dans le cyclopropane que dans le propane linéaire. La différence dans l'ébullition et les points de fusion entre les alcanes linéaires et cycloalcanos est due à de plus grandes forces de Londres, qui augmentent en raison de la forme du cycle qui permet à une plus grande zone de contact entre les atomes internes d'être.
Réactivité
La réactivité du cyclopropane.
Grâce à cela, le cyclopropane peut être séparé plus facilement et peut se comporter comme Alqueno dans certaines réactions. En fait, la réactivité extrême des mélanges cyclopropane-oxygène peut devenir un danger d'explosion.
Utilisations / applications
L'utilisation commerciale du cyclopropane par excellence est en tant qu'agent anesthésique, étudiant cette propriété pour la première fois en 1929.
Cyclo -own est un puissant agent anesthésique d'action rapide, qui n'irrite pas les voies respiratoires ou ne présente pas une mauvaise odeur. Il a été utilisé pendant plusieurs décennies avec les patients en oxygène pour dormir pendant les interventions chirurgicales, mais les effets secondaires indésirables représentés comme un «choc cyclopropane» ont commencé à être observés.
Avec les coûts du coût et de l'inflammabilité élevée, il traversait un processus de défausse et de remplacement par d'autres agents anesthésiques plus sûrs.
Bien qu'il ait continué à faire partie des composés utilisés dans l'induction de l'anesthésie, il ne fait aujourd'hui pas partie des agents utilisés dans les applications médicales.
Des risques
- Le cyclopropane est un gaz très inflammable, qui produit des gaz toxiques lorsqu'il entre en contact avec une flamme. De plus, il peut réagir avec des agents oxydants tels que des peroxydes, des peroxydes, des permangantes, des nitrates et des halogènes, provoquant des incendies et / ou des explosions.
Peut vous servir: acide chlorogénique- Le vélo à des niveaux élevés peut provoquer des maux de tête, des étourdissements, des nausées, une perte de coordination, une sensation d'évanouissement et / ou de l'évanouissement.
- Il peut également générer des irrégularités dans la fréquence cardiaque ou l'arythmie, les difficultés respiratoires, le coma et même la mort.
- Le cyclopropa liquéfié peut provoquer un gel de la peau en raison de sa température considérablement inférieure à zéro.
- Étant un gaz dans des conditions environnementales, ce composé peut facilement entrer dans le corps dans l'air et diminue également le niveau d'oxygène dans l'air.
- « Les 41 meilleures phrases d'amour d'anime
- 61 phrases de Captain America pour connaître ses idées »