Structure de cyclobutane, propriétés, utilisations et synthèse
- 4902
- 452
- Noa Da silva
Il Cyclobutane Il s'agit d'un hydrocarbure qui se compose d'un cyclocano à quatre carbone, dont la formule moléculaire est C4H8. Vous pouvez également être appelé tétraméthylène, étant donné qu'il y a quatre unités des Nations Unies2 qui constituent un anneau avec une géométrie carrée, bien que le nom du cyclobutane soit plus accepté et connu.
À température ambiante, c'est un gaz inflammable incolore qui brûle avec une flamme brillante. Son utilisation la plus primitive est comme source de chaleur en la brûlant; Cependant, sa base structurelle (le carré) couvre des aspects biologiques et chimiques profonds et collabore d'une certaine manière avec les propriétés desdits composés.
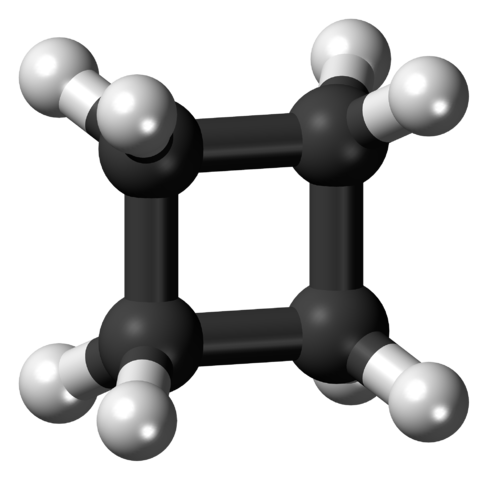 Molécule de cyclobutane dans la conformation tendue. Source: Jynto [CC0].
Molécule de cyclobutane dans la conformation tendue. Source: Jynto [CC0]. Dans l'image supérieure, une molécule de cyclobutane avec structure carrée est représentée. Dans la section suivante, il s'expliquera pourquoi cette conformation est instable, car ses liens sont tendus.
Après le cyclopropo, c'est le cycloalcan le plus instable, car plus la taille de l'anneau est petite, plus elle sera réactive. Selon cela, le cyclobutane est plus instable que les cycles pentan et hexano. Cependant, il est curieux de voir dans ses dérivés un cœur ou un cœur carré qui, comme on le verra, est dynamique.
[TOC]
Structure de cyclobutane
Dans la première image, la structure du cyclobutane a été considérée comme un simple carbone et carré hydrogéné. Cependant, dans ce carré parfait, les orbitales souffrent d'une entorse sévère de leurs angles d'origine: ils sont séparés par un angle de 90 ° par rapport à 109,5 ° pour un atome de carbone avec l'hybridation SPA SP3 (tension angulaire).
Points de carbone de voiture3 Ce sont des tétraédrales, et pour certains tétraèdres, il serait difficile de fléchir leurs deux orbitales pour créer un angle de 90º; Mais ce serait encore plus pour les carbones avec des hybridations SP2 (120º) et SP (180º) détourner vos angles d'origine. Pour cette raison, le cyclobutane a des atomes de carbone SP3 essentiel.
Peut vous servir: alcool secondaire: qu'est-ce que la structure, les propriétés, les utilisationsDe plus, les atomes d'hydrogène sont très proches les uns des autres, éclipsés dans l'espace. Il en résulte une augmentation de l'obstruction stérique, ce qui affaiblit le carré présumé pour sa tension de torsion élevée.
Par conséquent, les tensions angulaires et de torsion (encapsulées dans le terme «tension annulaire») rendent cette conformation instable dans des conditions normales.
Le cycloboutan.
Papillons ou conformations ridées
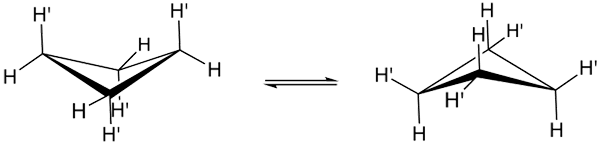 Conformations de cyclobutane. Source: Smokefoot.
Conformations de cyclobutane. Source: Smokefoot. Les vraies conformations du cyclobutano sont indiquées ci-dessus. En eux les tensions angulaires et en torsion diminuent; Puisque, comme on peut le voir, tous les atomes d'hydrogène ne sont pas éclipsés. Cependant, il y a un coût énergétique: l'angle de ses liens est exacerbé, c'est-à-dire bas de 90 à 88º.
Notez qu'il peut être comparé à un papillon, dont les ailes triangulaires sont formées par trois atomes de carbone; et le quatrième, positionné à un angle de 25º par rapport à chaque aile. Les flèches doubles soulignent qu'il y a un équilibre entre les deux conformères. C'est comme si le papillon descendait et grimpait ses ailes.
Dans ceux dérivés du cyclobutane, en revanche, il serait prévu que ce flottement soit beaucoup plus lent et spatialement empêché.
Interactions intermoléculaires
Supposons que vous oubliez quelques instants de carrés et que vous les remplacez en place par des papillons gazéifiés. Vous êtes dans leur flottement ne peut être maintenu ensemble que dans le liquide au moyen de forces de dispersion de Londres, qui sont proportionnelles à la zone de leurs ailes et à sa masse moléculaire.
Il peut vous servir: groupe carbonyle: caractéristiques, propriétés, nomenclature, réactivitéPropriétés
Apparence physique
Gaz incolore.
Masse moléculaire
56 107 g / mol.
Point d'ébullition
12,6 ° C. Par conséquent, dans des conditions froides, il pourrait être manipulé en principe comme n'importe quel liquide; Avec le seul détail, qu'il serait très volatil, et leurs vapeurs représenteraient toujours un risque à prendre en compte.
Point de fusion
-91 ° C.
point d'allumage
50 ° C une tasse fermée.
Solubilité
Insoluble dans l'eau, qui n'est pas surpris étant donné sa nature apolaire; Mais, il est légèrement soluble dans les alcools, l'éther et l'acétone, qui sont des solvants moins polaires. Il devrait être soluble (bien que non signalé) logiquement dans les solvants apolaires tels que le tétrachlorure de carbone, le benzène, le xylène, etc.
Densité
0,7125 à 5ºC (par rapport à 1 de l'eau).
Densité de vapeur
1,93 (par rapport à 1 de l'air). Cela signifie qu'il est dense que l'air, et donc, à moins qu'il y ait des courants, sa tendance ne s'assemblera pas.
La pression de vapeur
1.180 mmHg à 25 ° C.
Indice de réfraction
1 3625 à 290 ° C.
Enthalpie de combustion
-655,9 kJ / mol.
Chaleur de formation
6,6 kcal / mol A 25ºC.
La synthèse
Le cyclobutane est synthétisé par l'hydrogénation du cyclobutadiène, dont la structure est presque la même, avec la seule différence qu'il a une double liaison; Et par conséquent, c'est encore plus réactif. C'est peut-être la voie synthétique la plus simple pour l'obtenir, ou du moins seulement pour lui et non à un dérivé.
Dans le brut, il est peu probable qu'il obtienne car il finirait par réagir de telle manière qu'il a brisé l'anneau et que la chaîne de lignes a été formée, c'est-à-dire le n-butane.
Une autre méthode pour obtenir le cyclobutane consiste à influencer le rayonnement ultraviolet sur les molécules d'éthylène, CH2= Ch2, qui sont mesurés. Cette réaction est favorisée photochimiquement, mais pas thermodynamiquement:
Peut vous servir: benzoate benchilo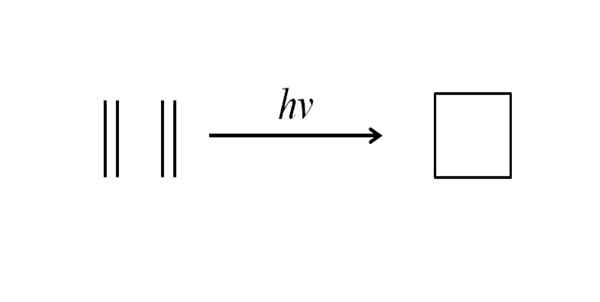 Synthèse du cyclobutane par rayonnement ultraviolet. Source: Gabriel Bolívar.
Synthèse du cyclobutane par rayonnement ultraviolet. Source: Gabriel Bolívar. L'image supérieure résume ce qui a été dit dans le paragraphe ci-dessus. Si au lieu de l'éthylène, c'était, par exemple, deux alcènes, un cyclobutane remplacé serait obtenu; ou quel est le même, un dérivé de cyclobutane. En fait, de nombreux dérivés avec des structures intéressantes ont été synthétisées par cette méthode.
D'autres dérivés, cependant, impliquent une série d'étapes synthétiques complexes. Par conséquent, les cyclobuta (comme leurs dérivés sont appelés), sont soumis à l'étude de la synthèse organique.
Applications
Le cyclobutane à lui seul n'a pas plus d'utilisation que de servir de source de chaleur; Mais, ses dérivés entrent dans des terres complexes dans la synthèse organique, avec des applications en pharmacologie, biotechnologie et médecine. Sans approfondir les structures trop complexes, les pénitrems et grandisol sont des exemples de cyclobutans.
Les cyclobutans ont généralement des propriétés bénéfiques pour les métabolismes des bactéries, des plantes, des invertébrés marins et des champignons. Ils sont biologiquement actifs, et c'est pourquoi leurs utilisations sont très variées et difficiles à spécifier, car chacune a son effet particulier sur certains organismes.
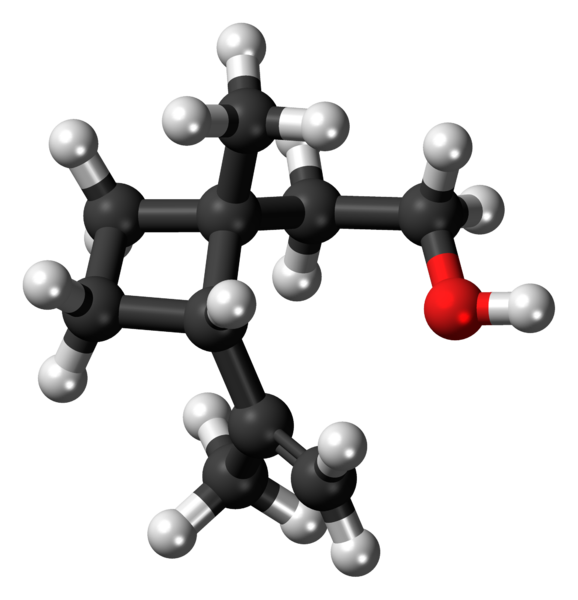
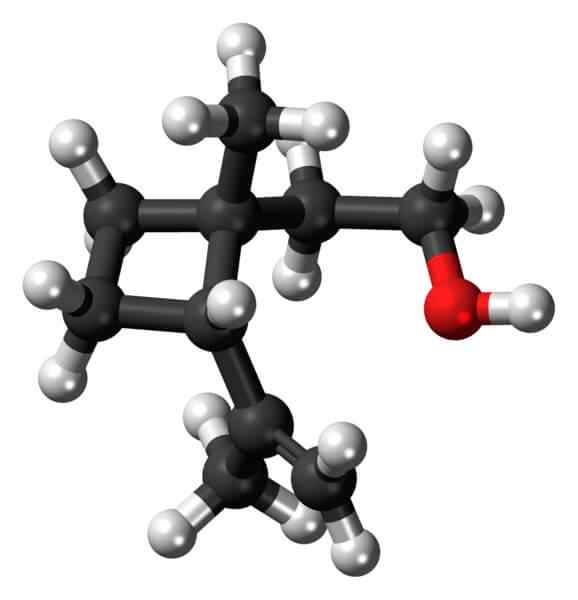 Grandisol: un exemple de dérivé de cyclobutane. Source: Jynto [CC0].
Grandisol: un exemple de dérivé de cyclobutane. Source: Jynto [CC0]. Grandisol, par exemple, est une phéromone Gorgjo (un type de scarabée). Au-dessus, et enfin, sa structure est montrée, considérée comme un monoterpène avec une base carrée de cyclobutane.
Les références
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons, t.W.; Craig B. Fryhle. (2011). Chimie organique. (onzee édition). Wiley.
- Wikipédia. (2019). Cyclobutane. Récupéré de: dans.Wikipédia.org
- Se publier. (2019). Cyclobutane. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Peiris Nicole. (29 novembre 2015). Propriétés physiques des cycloalcanes. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Wiberg B. Kenneth. (2005). Propriétés physiques du cyclobutane et études théoriques. Département de chimie, Université de Yale.
- Klement Foo. (s.F.). Cyclobutanes dans la synthèse organique. Récupéré de: Scripps.Édu
- Myers. (s.F.). Synthèse des cyclobutanes. Chem 115. Récupéré de: hwpi.Harvard.Édu
- « Structure Silver Bromuro (AGBR), propriétés et utilisations
- Caractéristiques, types et effets des médicaments synthétiques »

