Vélo
- 3295
- 462
- Mlle Ambre Dumont
 Cucloalquinos
Cucloalquinos Quels sont les cycloalquinos?
Les Vélo Ce sont des composés organiques, qui ont un ou plusieurs triples liens et une unité cyclique. Ses formules moléculaires condensées obéissent à la formule CnH2n-4. Ainsi, si n est égal à 3, alors la formule dudit cycloalquino sera c3H2.
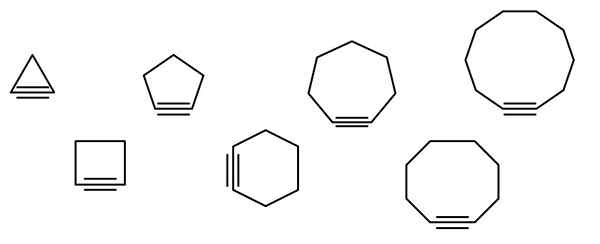
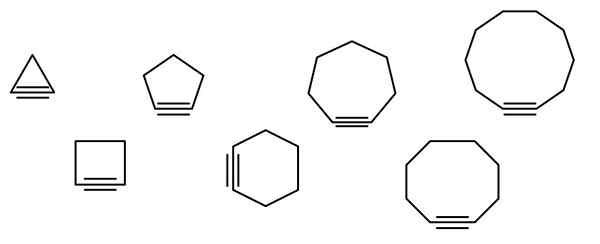
Dans l'image supérieure, une série de figures géométriques sont illustrées, mais cela consiste en réalité en des exemples de cycloalquins. Chacun d'eux peut être considéré comme une version plus oxydée des cycloalcanos respectifs (sans liens doubles ou triples). Quand ils manquent d'un hétéroátomo (o, n, s, f, etc.), ne sont que des hydrocarbures "simples".
La chimie autour des cycloalquinos est très complexe, et il y a encore plus de mécanismes derrière leurs réactions. Ils représentent un point de départ pour la synthèse de nombreux composés organiques, qui à leur tour sont soumis à des applications possibles.
En termes généraux, ils sont très réactifs à moins qu'ils soient "déformés" ou forment complexes avec des métaux de transition. De plus, leurs triples liaisons peuvent être combinées avec des liaisons doubles, créant des unités cycliques à l'intérieur des molécules.
N'étant pas le cas, dans leurs structures les plus simples, ils sont capables d'ajouter de petites molécules à leurs triples liaisons.
Caractéristiques des cycloalquins
Apolarité et triple lien
Les cycles sont caractérisés par des molécules apolaires, et par conséquent, hydrophobe. Cela peut changer si, dans leurs structures, ils ont un hétéroátomo ou un groupe fonctionnel qui confère un moment dipolaire considérable; Comme dans les hétérocycles avec des triples liens.
Mais qu'est-ce qu'un triple lien? Ce n'est rien de plus que trois interactions simultanées entre deux atomes de carbone avec l'hybridation SP. Un lien est simple (σ), et les deux autres π, perpendiculaires les uns aux autres. Les deux atomes de carbone ont une orbitale SP libre pour lier d'autres atomes (R-C≡C-R).
Il peut vous servir: radical à louer: comment ils sont formés, nomenclature, exemplesCes orbitales hybrides ont 50% de S et 50% du caractère P. Parce que l'orbital S est plus pénétrant que le P, ce fait fait les deux carbones de la triple liaison plus d'acides (accepteurs d'électrons) que les carbones des alcanes ou des alcènes.
Pour cette raison, Triple Bond (≡) représente un point spécifique pour que les espèces de donneurs d'électrons soient ajoutées à des liens simples.
Il en résulte la rupture de l'une des liaisons π, devenant une double liaison (c = c). L'ajout se poursuit jusqu'à R4C-CR4, c'est-à-dire des carbones complètement saturés.
Ce qui précède peut également être expliqué de cette manière: Triple Link est une double insaturation.
Forces intermoléculaires
Les molécules de cycloalcine interagissent par des forces de dispersion ou des forces de Londres et par des interactions de type π-x. Ces interactions sont faibles, mais à mesure que la taille des cycles augmente (comme les trois derniers sur le côté droit de l'image), ils parviennent à former des solides à la température et à la pression ambiante.
Tension angulaire
Les liens à triple liaison sont situés sur le même plan et une ligne. Par conséquent, -C≡C- a une géométrie linéaire, avec les orbitales d'environ 180 °.
Cela a une grave implication dans la stabilité stéréochimique des cycloalquins. Beaucoup d'énergie est nécessaire pour «plier» les Orbitals SP, car ils ne sont pas flexibles.
Plus le cycloalquino est petit, plus les SP orbitaux doivent être pliés pour permettre l'existence physique. En analysant l'image, on peut remarquer, de gauche à droite, que dans le triangle, l'angle des liens vers les côtés du triple lien est très prononcé; Pendant que dans le décagon, ils sont moins brusques.
Peut vous servir: bleu de méthylène: caractéristiques, préparation, utilisationsComme le cycloalquino est plus grand, l'angle des liens du SP orbital aux idéaux 180º est plus proche. L'inverse se produit lorsqu'ils sont plus petits, les forçant à se plier et à créer un tension angulaire En eux, l'installation du cycloalquino.
Ainsi, les plus grandes cycloalquins ont une tension angulaire plus faible, ce qui permet leur synthèse et leur stockage. Avec cela, le triangle est le cycle le plus instable, et le décagonal le plus stable de tous.
En fait, la cyclooctine (l'octogone) est celle avec la plus petite connue plus stable; D'autres n'existent que comme intermédiaires momentanés dans les réactions chimiques.
Nomenclature cycliste
Pour nommer les cycles. La seule différence réside dans le suffixe -ico à la fin du nom du composé organique.
La chaîne principale est celle qui a le triple lien et commence à être énuméré de l'extrémité le plus proche de ce. Si vous avez, par exemple, le cyclopropane. Si un groupe méthyle est lié sur le sommet supérieur, alors ce sera: 2-méthylciclopropino.
Les carbones R-C≡C-R ont déjà leurs quatre liaisons, il manque donc d'hydrogènes (comme pour toutes les cycloalquins de l'image). Cela ne se produit pas seulement si le triple lien est en position terminale, c'est-à-dire à la fin d'une chaîne (R-C≡C-H).
Applications de cycloalquine
Les cycloalcanes ne sont pas des composés très courants, donc leurs applications ne sont pas non plus. Ils peuvent servir de liants (groupes qui coordonnent) aux métaux de transition, créant ainsi une infinité de composés organométalliques qui peuvent être destinés à des utilisations très rigoureuses et spécifiques.
Peut vous servir: bisulfite de sodium (NAHSO3): structure, propriétés, utilisations, obtentionIls sont généralement solvables sous leurs formes les plus saturées et stables. Lorsqu'ils sont constitués d'hétérocycles, en plus d'avoir des unités cycliques C≡C-C = C-C≡C internes, ils trouvent des utilisations intéressantes et prometteuses telles que les médicaments anticancéreux; Tel est le cas de daémicine à. D'autres composés avec des analogies structurelles en ont synthétisé.
Exemples de cycloquinos
L'image montre sept cycloalquins simples, dans lesquels il n'y a pratiquement pas de triple lien. De gauche à droite, avec leurs noms respectifs qu'ils ont: le cyclopropino, le triangle; Ciclobutino, le carré; Cycopentine, le Pentagone; Cyclohexino, hexagone; Cycloheptino, l'heptagone; Cyclooctino, l'octogone; et cyclodécino, le décagon.
Sur la base de ces structures et le remplacement des atomes d'hydrogène des carbones saturés, d'autres composés en dérivent peuvent être obtenus. Ils peuvent également subir des conditions oxydatives pour générer des doubles liens sur d'autres côtés des cycles.
Ces unités géométriques peuvent faire partie d'une structure plus grande, augmentant les chances de fonctionnaliser l'ensemble entier. Il n'y a pas beaucoup d'exemples disponibles de cycloalcinos, du moins pas sans approfondir les terres de la synthèse organique et de la pharmacologie.
Les références
- Francis a. Écaille de tortue. Chimie organique. (Sixième édition., Page 372, 375). Mc Graw Hill.
- Wikipédia. (2018). Cycloalkyne. Pris de: dans.Wikipédia.org
- William Reusch. (05 mai 2013). Nommer les composés organiques. Pris de: 2.Chimie.MSU.Édu
- Chimie inorganique. Vélo. Tiré de: Fullquimica.com
- Patrizia Diana et Girolamo Cirrincione. (2015). Biosynthèse des hétérocycles de l'isolement à l'amas de gènes. Wiley, page 181.
- Chimie organique intéressante et produits naturels. (17 avril 2015). Cycloalkynes. Tiré de: Quintus.Mickel.ch

