Cation de formation, différences avec l'anion et les exemples

- 3438
- 354
- Prof Noah Collet
UN cation C'est une espèce chimique qui a une charge positive. Les deux types d'ions existants sont pour l'anion. Sa charge est le produit d'une carence en électrons dans l'atome, ce qui fait exercer une plus grande attraction aux protons de base. Pour chaque électron qui perd un atome neutre, la charge positive est augmentée dans une unité.
Si un atome perd un électron et, par conséquent, le nombre de protons est supérieur à un, alors sa charge positive sera +1; Si vous perdez deux électrons, la charge sera +2, et ainsi de suite. Lorsqu'un cation a une charge de +1, il est dit monovalent; D'un autre côté, si ledit charge est supérieur à +1, on dit que le cation est polyvalent.
 Hydronio ion, l'un des cations les plus simples. Source: Gabriel Bolívar.
Hydronio ion, l'un des cations les plus simples. Source: Gabriel Bolívar. Dans l'image supérieure, il est montré au cation h3SOIT+, appelé hydronio ion. Comme on peut le voir, il a à peine une charge de +1, conformément à un cation monovalent.
Les cations sont des espèces importantes, car elles exercent une force électrostatique avec leur environnement et les molécules autour. Ils ont une interaction élevée avec l'eau, du liquide qui les hydrate et les transporte dans des sols humides, puis atteignent les racines des plantes et être utilisés pour leurs fonctions physiologiques.
[TOC]
Comment se forme un cation?
Il a été mentionné que lorsqu'un atome perd un électron, son plus grand nombre de protons, par rapport aux électrons, exerce une force d'attraction qui se traduit par une charge positive. Mais comment la perte d'électrons peut-elle se produire? La réponse dépend de la transformation qui s'est produite dans les réactions chimiques.
Il convient de noter que la présence d'un atome à charge positive n'implique pas nécessairement la formation d'un cation. Pour qu'il puisse être considéré comme tel, il ne devrait pas y avoir d'atome avec une charge formelle négative qui neutralise. Sinon, il y aurait une attraction et une répulsion dans le même composé et serait neutre.
Peut vous servir: sulfate de calcium (cas4): structure chimique, propriétés, utilisationsFrais formels et plus de liens
Les atomes électronégatifs attirent les électrons de leurs liaisons covalentes vers eux. Bien que les électrons soient partagés de manière égale, il y a un point où ils auront partiellement moins d'électrons que dans leur configuration basale; C'est celle de leurs atomes libres sans être liés à d'autres éléments.
Ensuite, ces atomes électronégatifs commenceront à ressentir une carence en électrons, et avec elle, les protons de leurs noyaux exerceront une force de plus grande attraction; La charge formelle positive est née. S'il n'y a qu'une charge formelle positive, le composé manifestera une charge ionique positive globale; Ainsi le cation est né.
L'atome d'oxygène du cation h3SOIT+ C'est un exemple fidèle de ce qui précède. En ayant trois liaisons O-H, une de plus que dans la molécule d'eau (H-O-H), subit la perte d'un électron par rapport à son état basal. Les calculs des charges formelles permettent de déterminer quand cela se produit.
Si la formation d'un autre O-H est supposée pendant un instant, le cation divalent sera obtenu4SOIT2+. Notez que la charge divalent au-dessus du cation est écrite comme suit: le nombre suivit le symbole '+'; De la même manière, les anions sont procédés.
Oxydation
Les métaux sont des formateurs de cations par excellence. Cependant, tout le monde ne peut pas former des liaisons covalentes (ou du moins purement covalentes). Au lieu de cela, ils perdent des électrons pour établir des liaisons ioniques: une charge positive attire un négatif, uni par les forces physiques.
Par conséquent, les métaux perdent des électrons pour passer de m à mn+, où n Il est généralement égal au nombre de votre groupe dans le tableau périodique; même si n Vous pouvez prendre plusieurs valeurs entières, qui se produisent surtout avec les métaux de transition. Cette perte d'électrons est effectuée dans un type de réaction chimique appelée oxydation.
Peut vous servir: alcool tertiaire: structure, propriétés, exemplesLes métaux oxydent, perdent un électron, le nombre de protons de leurs atomes dépasse celui des électrons et présente par conséquent une charge positive. Pour qu'il y ait de l'oxydation, il doit y avoir un agent oxydant, qui réduit ou gagne des électrons perdus par les métaux. L'oxygène est l'agent oxydant le plus connu de tous.
Différences avec Anion
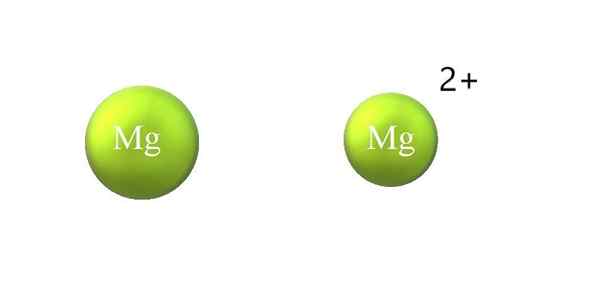 Contraction du rayon atomique dans un cation. Source: Gabriel Bolívar.
Contraction du rayon atomique dans un cation. Source: Gabriel Bolívar. Voici les différences entre un cation et un anion:
-Le cation général est plus petit que l'anion. L'image supérieure montre comment le rayon atomique du Mg est réduit en perdant deux électrons et en devenant le cation Mg2+; L'inverse se produit avec des anions: ils deviennent plus encombrants.
-Il a plus de protons que d'électrons, tandis que Anion a plus d'électrons que de protons.
-Étant plus petite, sa densité de charge est plus élevée et a donc une plus grande puissance polarisante; c'est-à-dire déforme les nuages électroniques des atomes voisins.
-Un cation se déplace dans le même sens que celui du champ électrique appliqué, tandis que l'anion le fait dans la direction opposée.
Exemples des cations les plus courantes
Monoatomique
Les cations monoatomiques proviennent principalement de métaux (à l'exception de certaines exceptions, telles que H+). Du reste, il est extrêmement rare de considérer un cation dérivé d'un élément non métallique.
On verra que beaucoup d'entre eux sont di ou polyvalents, et que les amplitudes de leurs charges sont d'accord avec le nombre de leurs groupes dans le tableau périodique.
Il peut vous servir: Ribulosa-1,5-Biphosphate (RUBP): Caractéristiques, carbolixation-Li+
-N / A+
-K+
-RB+
-CS+
-Frousser+
-Agir+
Tous ont en commun la charge «1+», qui est écrite sans placer le nombre, et proviennent également du groupe 1: Métaux alcalins. De plus, il y a le cation ag+, L'un des métaux de transition les plus courants.
-Être2+
-Mg2+
-CA2+
-M2+
-Ba2+
-Rampe2+
Ces cations divalents dérivent de leurs métaux respectifs appartenant au groupe 2: métaux alcalinerior.
-Au3+
-Géorgie3+
-Dans3+
-Tl3+
-NH3+
Cations trivalentes du groupe Boro.
Jusqu'à présent, les exemples ont été caractérisés par une seule valence ou un chargement. D'autres cations présentent plus d'une valence ou d'un état d'oxydation positif:
-Sn2+
-Sn4+ (étain)
-Co2+
-Co3+ (cobalt)
-Au+
-Au3+ (or)
-Foi2+
-Foi3+ (fer)
Et d'autres métaux, comme le manganèse, peuvent encore avoir beaucoup plus de valences:
-MN2+
-MN3+
-MN4+
-MN7+
Plus la charge est grande, plus petite et polarisante sera le cation.
Polyiatomique
Sans entrer dans la chimie organique, il existe des cations inorganiques et polylamiques qui sont très courantes dans la vie quotidienne; comme:
-H3SOIT+ (Hydronio, déjà mentionné).
-NH4+ (ammonium).
-NON2+ (Nitronio, présent dans les processus de nitration).
-PH4+ (Phosphonium).
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Helmestine, Anne Marie, Ph.D. (5 mai 2019). Définition et exemple Cation. Récupéré de: Thoughtco.com
- Wyman Elizabeth. (2019). Cation: définition et exemple. Étude. Récupéré de: étudier.com
- Nuls. (2019). Ins positifs et négatifs: cations et anions. Récupéré de: mannequins.com
- Wikipédia. (2019). Cation. Récupéré de: est.Wikipédia.org
- « Structure Anisol, propriétés, nomenclature, risques et utilisations
- Origine archéolithique, caractéristiques, climat, flore et faune »

