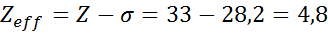Charge nucléaire efficace
- 605
- 139
- Noa Da silva
Quelle est la charge nucléaire efficace?
La Charge nucléaire efficace (représenté comme zEffesser Et dans certains cas comme z*) C'est la charge nucléaire nette qu'un électron éprouve lorsqu'il se trouve dans un atome polyhélectronique (c'est-à-dire qu'il a plus d'un électron).
D'une manière plus précise, c'est la charge électrique qui aurait le cœur d'un atome hypothétique capable d'attirer son seul électron avec la même force avec laquelle le noyau de l'atome réel attire ce même électron en présence de tous les autres électrons.
Il s'agit d'une charge nucléaire corrigée qui prend en compte l'effet de la présence d'autres électrons sur un atome polylectronique. Cette charge réduite explique pourquoi les électrons les plus externes dans un atome polyhélectronique sont plus faiblement liés au noyau que les électrons internes.
La charge nucléaire efficace est un concept d'une grande importance en chimie, car il nous permet de comprendre la tendance périodique de nombreuses propriétés telles que le rayon atomique, le rayon d'ions, l'électronégativité, les énergies d'ionisation et plus encore.
Pourquoi la charge nucléaire efficace existe-t-elle?
La charge nucléaire efficace provient de deux phénomènes:
- L'effet de blindage des électrons sur les atomes polyhélectroniques.
- Répulsion électrostatique parmi les électrons parce que tout le monde a la même charge électrique.
Il effet de blindage Il se compose d'une sorte de bouclier formé par les électrons internes d'un atome qui couvre le noyau. Cela fait que les électrons les plus externes "ressentent" une attraction inférieure de la partie du noyau qu'elles ne le ressentiraient si les autres électrons n'étaient pas présents.
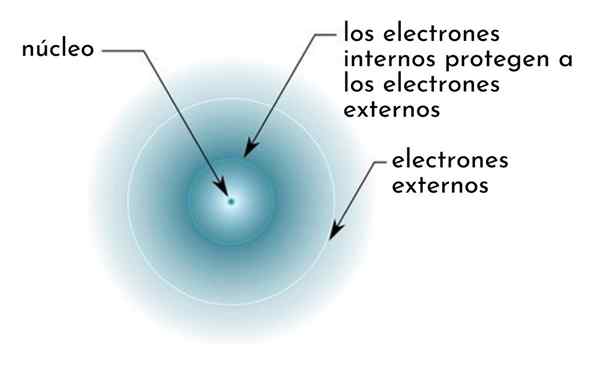 Figure montrant schématiquement des électrons internes agissant comme un écran qui protège les électrons externes de l'attraction du noyau
Figure montrant schématiquement des électrons internes agissant comme un écran qui protège les électrons externes de l'attraction du noyau Par exemple, la charge nucléaire de l'atome de sodium est +11 (son nombre atomique est z = 11), mais, le seul électron de Valence qu'il possède, ressent en fait la force d'attraction d'une charge de seulement +2,2.
Peut vous servir: benzoate de sodium: structure, propriétés, utilisations et risquesEn d'autres termes, le blindage des 10 autres électrons internes fait que l'électron de valence du sodium ressent une force d'attraction nucléaire du cinquième de ce qui devrait être.
En plus de l'effet de blindage, le Répulsion entre les électrons (qui ont la même charge électrique) contribue également à contrer la capacité du noyau pour attirer des électrons externes. C'est-à-dire que cette répulsion aide également à réduire la charge nucléaire efficace.
Caractéristiques importantes d'une charge nucléaire efficace
Il convient de noter que l'effet de blindage responsable de la réduction de la charge nucléaire efficace n'affecte que les électrons qui sont dans le même niveau d'énergie ou dans les couches supérieures, mais pas les électrons les plus internes. De plus, l'effet n'est pas le même pour les électrons trouvés dans les orbitales atomiques S et P que celles trouvées dans les orbitales D et F.
Pour cette raison, chaque ensemble d'électrons de chaque couche ou niveau d'énergie ressent une charge nucléaire efficace différente. Cela a des implications importantes concernant les propriétés chimiques des différents éléments.
Tendance périodique d'une charge nucléaire efficace
Sur une période
Les électrons situés au même niveau d'énergie sont moins blindants que ceux trouvés dans les niveaux d'énergie inférieurs.
Pour cette raison, l'effet de blindage n'augmente pas considérablement à mesure que nous nous déplaçons sur une période, mais la véritable charge nucléaire. Pour cette raison, la charge nucléaire efficace augmente de gauche à droite dans le tableau périodique.
Tout au long d'un groupe
D'un autre côté, en passant d'une période à un autre dans le même groupe (c'est-à-dire lorsque nous descendons le long d'un groupe), des couches entières d'électrons internes très protégées sont ajoutés. Cela fait que la charge nucléaire effective diminuait de haut en bas ou, quel est le même, Augmenter de bas en haut.
Peut vous servir: ayaroínaFormule de charge nucléaire efficace
La charge nucléaire efficace peut être calculée au moyen d'une équation semi-temps très simple qui prend en compte la valeur réelle de la charge nucléaire (donnée par le nombre atomique, z) et un terme appelé blindage constant. Ce dernier englobe les effets de la présence d'autres électrons dans un.
L'équation est donnée par:
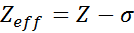
où z est le nombre atomique et σ (Lettre grecque Sigma) représente la constante de blindage, qui dépend de la configuration électronique.
Règles de slater
La constante de blindage peut être estimée à partir d'un système connu sous le nom de règles de Slater. Ces règles permettent de calculer la constante de bouclier d'un électron en ajoutant les contributions des autres électrons à ladite constante de blindage. Ces règles peuvent être résumées comme suit:
- Tout électron qui est au même niveau d'énergie (niveau n0) Fournit une quantité de 0,35 à la constante de blindage, sauf si les deux sont au niveau 1, auquel cas il fournit 0,30.
- Chaque électron qui est au niveau immédiatement précédent (au niveau n0-1) Dans une orbite S ou P, il apporte 0,85; D'un autre côté, s'il est dans une orbite D ou F, il contribue 1.
- Tous les autres électrons qui sont à des niveaux d'énergie plus faibles (n0-2, n0-3, etc.), contribuer 1 à la constante de blindage.
Exemple de calcul de charge nucléaire efficace
Électron de valence de l'atome de sodium
La configuration électronique de l'atome de sodium est 122s22 P63s1. C'est-à-dire que si nous voulons calculer la charge nucléaire efficace que ressent l'électron de Valencia (l'électron 3S1), nous devons ajouter les contributions des 10 autres électrons en suivant les règles de Slater.
Peut vous servir: Oxyde de fer (II): structure, nomenclature, propriétés, utilisationsComment calculons-nous la constante du bouclier électronique 3S1 (n0= 3) Et c'est seul dans la couche de Valencia, il n'y a pas d'autres électrons au même niveau d'énergie.
Le niveau immédiatement précédent est n0-1 = 2, où il y a 8 électrons dans les orbitaux S ou P qui contribuent 0,85 chacun, et il n'y a pas d'électrons dans les orbitales D ou F.
Enfin, le seul niveau inférieur à 2 est n = 1, dans lequel il n'y a que 2 électrons. Tout cela est résumé dans le tableau suivant:
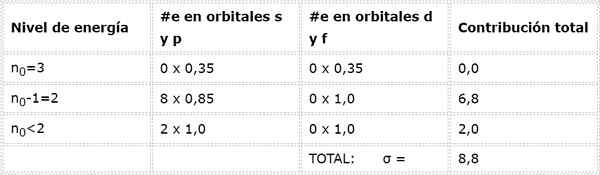
Comme on peut le voir, les électrons internes du sodium fournissent une constante de bouclier de 8,8, donc la charge nucléaire efficace que l'électron ressent 3S1 est:
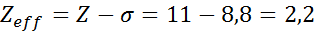
Electrons de Valencia en arsenic
La configuration électronique de l'arsenic est 122s22 P63s23p63Ddix4s24p3. La couche de valence est la couche 4 (n0= 4) qui a 5 électrons: (4S24p3). Dans ce cas, chacun de ces 5 électrons ressentira l'effet des 4 autres qui se trouvent dans la même couche et celui des 28 autres électrons internes comme indiqué dans le tableau:
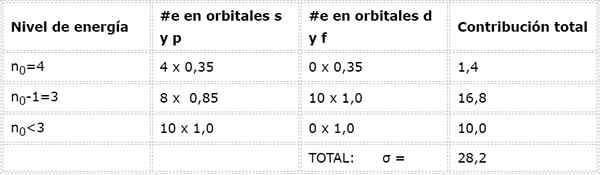
Par conséquent, la charge nucléaire efficace que ressentent les électrons de l'Arsenic Valencia est: