Carbonate d'ammonium ((NH4) 2CO3)
- 1732
- 79
- Lucas Schneider
Qu'est-ce que le carbonate d'ammonium?
Il Carbonate d'ammonium Il s'agit d'un sel d'azote inorganique, en particulier à l'ammoniacal, dont la formule chimique est (NH4)2CO3. Il est élaboré par des méthodes de synthèse, parmi lesquelles il vaut la peine d'utiliser la sublimation d'un mélange de sulfate d'ammonium et de carbonate de calcium: (NH4)2Swin4(s) + caco3(s) => (nh4)2CO3(s) + cas4(S).
Généralement, les sels d'ammonium et le carbonate de calcium sont chauffés dans un récipient pour provoquer un carbonate d'ammonium. La méthode industrielle qui produit des tonnes de ce sel consiste à passer du dioxyde de carbone à travers une colonne d'absorption qui contient une solution d'ammonium dans l'eau, puis à effectuer une distillation.
Les vapeurs contenant de l'ammonium, du dioxyde de carbone et de l'eau sont condensés pour former des cristaux de carbonate d'ammonium: 2NH3(g) + h2Ou (l) + co2(g) → (NH4)2CO3(S). Dans la réaction, l'acide carbonique se produit, H2CO3, Après avoir disséqué le dioxyde de carbone dans l'eau, et c'est cet acide qui donne ses deux protons, H+, à deux molécules d'ammoniac.
Propriétés du carbonate d'ammonium
 Aspect du carbonate d'ammonium
Aspect du carbonate d'ammonium C'est un solide blanc, cristallin et incolore, avec de fortes odeurs et des saveurs d'ammoniac. Fond à 58 °.
Cependant, cette décomposition se produit en deux étapes: d'abord une molécule NH est libérée3, Produire du bicarbonate d'ammonium (NH4HCO3)); Et deuxièmement, si le chauffage continue, le carbonate est une disproportion.
C'est un solide soluble dans l'eau et moins soluble dans les alcools. Formez des ponts d'hydrogène avec de l'eau et lorsque 5 grammes se dissolvent dans 100 grammes d'eau, il génère une solution de base avec un pH autour de 8,6.
Peut vous servir: émulsifiant: processus d'émulsion, aspects moléculaires, applicationsSa haute affinité pour l'eau est faite par un solide hygroscopique (il absorbe l'humidité), et c'est pourquoi il est difficile de le trouver sous sa forme d'anhydride. En fait, sa forme monohydrate (NH4)2CO3· H2O), est le plus courant de tous et explique comment le sel est un support de gaz d'ammoniac, provoquant une odeur.
Dans l'air, il se décompose pour générer du bicarbonate d'ammonium et du carbonate d'ammonium (NH4NH2CO2).
Structure chimique
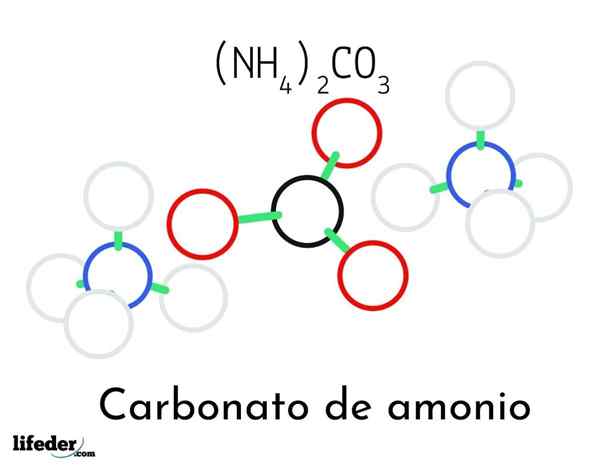
 Modèle de structure de carbonate d'ammonium; Deux cations d'ammonium et d'un carbonate
Modèle de structure de carbonate d'ammonium; Deux cations d'ammonium et d'un carbonate Dans l'image supérieure, la structure chimique du carbonate d'ammonium est illustrée. Au milieu est l'anion co32-, le triangle plat avec le centre noir et les sphères rouges; Et de ses deux côtés, les cations Ammonios NH4+ avec des géométries tétraédriques.
La géométrie de l'ion ammonium s'explique par l'hybridation SP3 de l'atome d'azote, ordonnant les atomes d'hydrogène (les sphères blanches) autour de lui sous la forme d'un tétraèdre. Parmi les trois ions sont établis par des ponts d'hydrogène (h3N-h-o-co22-).
Grâce à sa géométrie, un seul co -anion32- peut former jusqu'à trois ponts d'hydrogène; tandis que les cations nh4+ Peut-être ne peuvent-ils pas former leurs quatre ponts hydrogène correspondants en raison des répulsions électrostatiques parmi leurs charges positives.
Le résultat de toutes ces interactions est la cristallisation d'un système ortorrombique. Pourquoi est-ce si hygroscopique et soluble dans l'eau? La réponse est dans le même paragraphe précédent: les ponts d'hydrogène.
Ces interactions sont responsables de l'absorption rapide de l'eau du sel d'anhydride pour se former (NH4)2CO3· H2SOIT). Il en résulte des changements dans la disposition spatiale des ions, et donc, dans la structure cristalline.
Il peut vous servir: chlorure de nickel (NICL2): structure, propriétés, obtention, utilisationsCuriosités structurelles
Peu importe à quel point le NH ressemble à la simplicité4)2CO3, Il est si sensible aux innombrables transformations que sa structure est un mystère soumis à la véritable composition du solide. Cette structure varie également selon les pressions qui affectent les cristaux.
Certains auteurs ont constaté que les ions sont ordonnés comme coplanares bordés de ponts d'hydrogène (c'est-à-dire une chaîne avec une séquence NH4+-CO32--…) Dans lequel les molécules d'eau servent probablement de connecteurs à d'autres chaînes.
Encore plus, transcendant le ciel terrestre, comment sont ces cristaux dans des conditions spatiales ou interstellaires? Quelles sont vos compositions en termes de stabilité des espèces gazeuses? Il y a des études qui confirment la grande stabilité de ces cristaux piégés dans les masses de glace planétaire et comètes.
Cela leur permet de servir de réserves de carbone, d'azote et d'hydrogène qui, recevant un rayonnement solaire, peuvent être transformées en matières organiques telles que les acides aminés.
C'est-à-dire que ces blocs ammoniacaux de crème glacée pourraient être des porteurs de "la roue qui commence la machinerie de la vie" dans le cosmos. Pour ces raisons, leur intérêt pour le domaine de l'astrobiologie et de la biochimie augmente.
Utilisations / applications
Il est utilisé comme Leuers, car être chauffé produit du dioxyde de carbone et des gaz d'ammonium. Le carbonate d'ammonium est, si vous le souhaitez, un précurseur de la levure chimique moderne et peut être utilisé pour cuire des biscuits et des biscuits plats.
Cependant, son utilisation pour cuire les gâteaux n'est pas recommandé. En raison de l'épaisseur des gâteaux, les gaz d'ammonium sont conservés à l'intérieur et produisent une saveur désagréable.
Il peut vous servir: Cyclohexen: structure, propriétés, synthèse et utilisationsIl est utilisé comme expectorant, c'est-à-dire soulage la toux lors de la décongestion des bronches. Il a une action fongicide, en utilisant pour cette raison dans l'agriculture. Il s'agit également d'un régulateur de l'acidité présente dans les aliments et est utilisé dans la synthèse biologique de l'urée en haute pression, et HidantOoinas.
Des risques
Le carbonate d'ammonium est très toxique. Il produit chez l'homme une irritation aiguë de la cavité orale lors de la mise en contact.
De plus, si l'ingération provoque une irritation gastrique. Une action similaire est observée dans les yeux exposés au carbonate d'ammonium.
L'inhalation des gaz de décomposition du sel, peut irriter le nez, la gorge et les poumons, provoquant une toux et une détresse respiratoire.
L'exposition aiguë des chiens sur l'ammonate d'ammonate à une dose de 40 mg / kg de poids, provoque des vomissements et de la diarrhée. Les doses les plus élevées de carbonate d'ammonium (200 mg / kg de poids) sont généralement mortelles. Les dommages cardiaques sont indiqués comme la cause du décès.
S'il est chauffé à des températures très élevées et dans un air enrichi d'oxygène, il dégage des gaz toxiques2.
Les références
- Se publier. (2018). Carbonate d'ammonium. Récupéré le 25 mars 2018 de PubChem: PubChem.NCBI.NLM.NIH.Gouvernement
- Portail de chimie organique. ((2009-2018)). Réaction de bucherer-bergs. Récupéré le 25 mars 2018 du portail de chimie organique: www.Chimie organique.org
- Wikipédia. (2018). Carbonate d'ammonium. Récupéré le 25 mars 2018 de Wikipedia: en.Wikipédia.org
- La société chimique. (2018). La société chimique. Récupéré le 25 mars 2018 de la société chimique: Thechemco.com