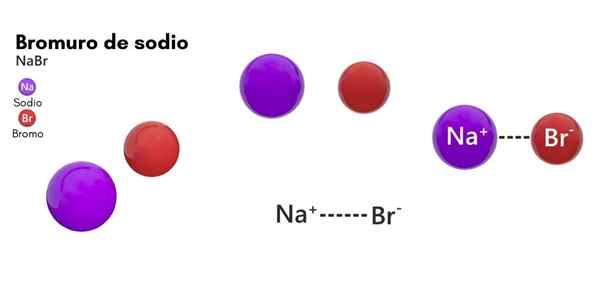
Bromure de sodium (NABR)
- 4369
- 443
- Noa Da silva
Qu'est-ce que le bromure de sodium?
Il bromure de sodium C'est une espèce chimique qui appartient aux sels d'origine inorganique. Sa structure est composée de l'halogène brommique et de l'élément métallique de sodium en 1: 1. Sa formule chimique est nabab et est dans un état d'agrégation solide dans des conditions de température standard (25 ° C et 1 atm).
Normalement, il peut être observé comme une poussière blanche et est considéré comme un composé de type cristallin qui manifeste également un comportement hygroscopique; c'est-à-dire qu'il a la capacité d'absorber l'humidité de son environnement.
De même, le bromure de sodium a des caractéristiques physiques très similaires à un autre composé ionique du même métal: le chlorure de sodium. Ce chlorure est représenté comme NaCl, qui est plus communément appelé sel commun ou sel de table.
Il a un grand nombre d'utilisations dans différents domaines de la science; Par exemple, il est utilisé dans la production de divers types de médicaments (sédatifs, hypnotiques, anticonvulsive, entre autres), comme dans la synthèse organique et même dans les applications de photographie.
Structure chimique
Le bromure de sodium est présenté en phase solide et, comme de nombreux autres sels de nature inorganique, il a une conformation structurelle cristalline.
Cette molécule cristalline, constituée par un brome et une d'hydrogène, a une conformation cubique centrée sur les faces, telles que les sels de type haloïde du même métal (NAI, NAF et NaCl).
Cette disposition moléculaire forme la base structurelle de nombreux composés, dans lesquels l'ordre est effectué de sorte que chaque ion soit maintenu au centre d'une figure octaédrique, comme indiqué dans l'image suivante.
Peut vous servir: acide phosphoreux (H3PO3)
Dans ce type de verre, vous pouvez voir comment chacun des ions a autour de lui encore six ions - qui ont une charge électrique contraire - qui sont situées aux extrémités de la figure octaédrique.
De même, la structure de cette substance ionique implique qu'il a un point de fusion élevé d'environ 747 ° C, étant commercialement sous ses deux formes: une espèce anhydre (sans molécules d'eau) et une espèce dihydratée (avec deux molécules d'eau dans sa formule structurelle (Nabr · 2h2O)), dont les points de fusion sont différents.
Synthèse chimique
Le bromure de sodium provient de la réaction chimique qui se produit entre le bromure d'hydrogène (BRH, un halogénure d'hydrogène en phase gazeuse) et l'hydroxyde de sodium (NaOH, une base forte en phase solide et avec des propriétés hygroscopiques)).
De cette façon, il est fabriqué commercialement, ajoutant un excès de brome à une solution de NaOH. Ainsi, un mélange de bromure / brome est formé. Par la suite, les produits résultants sont soumis à une évaporation jusqu'à ce qu'ils soient secs et sont traités avec du carbone pour générer la réaction de l'ion bromate (bro3-) à l'ion bromure (br-).
Neutralisation
De même, ce sel inorganique peut également se produire par une réaction de neutralisation du carbonate de sodium (Na2CO3) Avec de l'acide bromique (HBRO3), suite à la même procédure décrite ci-dessus.
Grâce à une synthèse, cette substance peut être produite par la réaction entre le fer avec le brome et l'eau. En tant que produit de cette réaction, les espèces de bromure phérique ferreuses proviennent.
Peut vous servir: alcoolsPar la suite, cette espèce s'est formée (représentée comme février2/ Février3) est dissous dans l'eau et une certaine quantité de carbonate de sodium est ajoutée. Enfin, la solution est filtrée et passe par un processus d'évaporation pour obtenir enfin le bromure de sodium.
Propriétés du bromure de sodium
- Il est généralement dans un état d'agrégation solide, sous forme de poussière blanche.
- Il a une structure cristalline, avec un ordre moléculaire sous forme de cube centré sur les faces.
- Le point de fusion de cette substance est d'environ 747 ° C pour la forme anhydre et 36 ° C pour sa forme de dihydrate, présentant une décomposition avant de fondre.
- Il est composé d'un ion sodium (na+) et un ion bromure (br-), avec une masse molaire ou un poids moléculaire de 102,89 g / mol.
- Son point d'ébullition est assez élevé, observant 1390 ° C (équivalent à 2530 ° F ou 1660 K).
- La solubilité de cette espèce est d'environ 94,32 g / 100 ml dans l'eau à 25 ° C, augmentant lorsque la température augmente.
- En subissant un chauffage au point où il se décompose, cette substance libère des gaz de brome et de l'oxyde de sodium considéré comme toxique.
- La densité de la forme anhydre de bromure de sodium est de 3,21 g / cm3, Tandis que le composé dihydraté est de 2,18 g / cm3.
- Sa solubilité dans l'alcool est considérée comme modérée, comme dans d'autres solvants tels que la pyridine, l'ammoniac et l'hydraction.
- Il présente l'insolubilité contre l'acétonitrile et l'acétone.
Utilisations / applications
- Dans la zone médicale, il est utilisé comme médicament pour un grand nombre de conditions qui proviennent des crises et comme thérapie pour prévenir les images d'épilepsie chez les patients atteints du syndrome de Wolf-Hirschhorn, ainsi que des traitements sédatifs et hypnotiques.
Il peut vous servir: acide bromique (HBRO3): propriétés, risques et utilisations- En médecine vétérinaire, il est utilisé chez les chiens qui souffrent de troubles convulsifs en raison des effets secondaires des médicaments tels que la primidone ou le phénobarbital.
- Dans le domaine de l'industrie pétrolière, il est utilisé dans les processus de préparation de certains fluides de densité variée qui sont utilisés dans les puits de pétrole.
- Dans le domaine de la recherche biologique, ses propriétés microbiocides ont été prouvées; c'est-à-dire qu'il est utilisé pour contrôler le développement de différents types de bactéries.
- Dans certaines synthèses de type organique, ce sel inorganique est utilisé pour la préparation d'autres espèces constituées par Bromo. Par exemple, par la réaction de Finkelstein, certains halogénures d'alkyle de réactivité sont obtenus, dont l'un était autrefois utilisé en photographie.
- Dans la zone de nettoyage et de désinfection, le bromure de sodium est utilisé en combinaison avec du chlore pour l'assainissement de grands volumes d'eau, comme dans les piscines et les jacuzzis.