Bromure d'hydrogène (HBR)
- 2286
- 486
- Paul Dumas
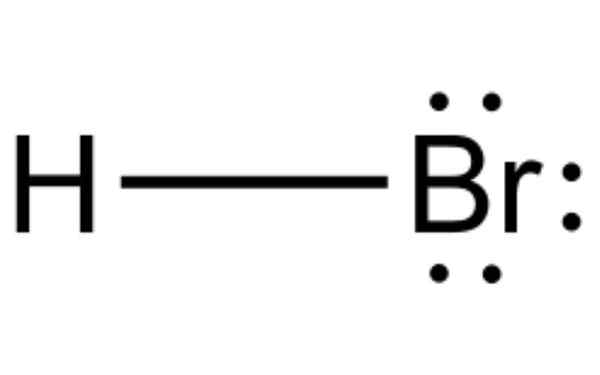 Le bromure d'hydrogène est un composé chimique qui forme de l'acide bromhorique dans l'eau. Source: Rafał Rx
Le bromure d'hydrogène est un composé chimique qui forme de l'acide bromhorique dans l'eau. Source: Rafał Rx Il Bromure d'hydrogène C'est une molécule diatomique avec une liaison covalente. Le composé est classé comme un halogénure d'hydrogène, étant un gaz incolore qui s'est dissous dans l'acide bromhytérique d'eau.
Proprietes physiques et chimiques
- Le bromure d'hydrogène est un gaz incolore à température ambiante, avec une odeur aigre et irritante. Le composé est stable, mais s'assombrit légèrement lorsqu'il est exposé à l'air ou à la lumière.
- Il a un poids moléculaire de 80.91 g / mol et une densité de 3 307 g / L, ce qui le rend plus lourd que l'air. Le gaz se condense produisant un liquide d'ébullition incolore de -66,73 ° C.
- En continuant à refroidir, le liquide se solidifie, obtenant des cristaux blancs, dont le point de fusion est de -86,82 ° C, avec une densité de 2 603 g / ml.
- Le bromure d'hydrogène est plus soluble dans l'eau que le chlorure d'hydrogène, en mesure de dissoudre 221 g dans 100 ml d'eau à 0 ° C, ce qui équivaut à un volume de 612 litres de ce gaz pour chaque litre d'eau. Il est également soluble dans l'alcool et d'autres solvants biologiques.
- En solution aqueuse (acide bromhydrique), les propriétés acides du HBR sont dominantes (comme c'est le cas de HF et HCl) et, dans le lien entre l'hydrogène et l'halogène, il est plus faible dans le cas du bromure d'hydrogène que dans le chlorure d'hydrogène.
Par conséquent, si le chlore passe par le bromure d'hydrogène, la formation de vapeurs brunes caractéristiques du brome moléculaire est observée. La réaction qui l'explique est la suivante:
2HBR + CL2 → 2hcl + br2
Cela indique que le bromure d'hydrogène est un agent réducteur plus fort que le chlorure d'hydrogène et que le chlorure d'hydrogène est un meilleur agent oxydant.
- Le bromure d'hydrogène est un acide anhydre fort (sans eau). Réagir rapidement et exothermiquement avec des bases de toutes sortes (y compris les amines et les amides).
Peut vous servir: amines- Réagir exothermiquement avec les carbonates (y compris les matériaux de calcaire et de construction qui le contiennent) et les carbonates d'hydrogène pour générer du dioxyde de carbone.
- Réagit avec les sulfures, les carbures, les boruros et le phosphon pour générer des gaz toxiques ou inflammables.
- Réagit avec de nombreux métaux (y compris l'aluminium, le zinc, le calcium, le magnésium, le fer, l'étain et tous les métaux alcalins) pour générer des gaz hydrogène inflammables.
Réactivité et dangers
Le bromure d'hydrogène est un composé corrosif et irritant. Il est extrêmement dangereux en cas de contact cutané (irritant et corrosif) et des yeux (irritants) et en cas d'ingestion et d'inhalation (irritant pulmonaire).
Le composé est économisé dans des conteneurs sous pression de gaz liquéfié. Une exposition prolongée à la chaleur ou à la chaleur intense peut entraîner la rupture violente du récipient sous pression, qui peut être déclenché en libérant des vapeurs toxiques irritantes.
Une exposition prolongée à de faibles concentrations ou à une exposition à court terme à des concentrations élevées peut entraîner des effets néfastes sur la santé dus à l'inhalation.
La décomposition thermique du bromure d'hydrogène anhydre produit du brome toxique. Il peut devenir inflammable s'il réagit en libérant de l'hydrogène. En contact avec le cyanure, il produit des gaz de cyanure d'hydrogène toxique.
Si ce produit chimique en solution entre en contact avec les yeux, ils doivent être lavés immédiatement avec de grandes quantités d'eau, soulevant parfois les paupières inférieures et supérieures.
Aucune lentille de contact ne doit être utilisée lorsque vous travaillez avec ce produit chimique. Si le tissu oculaire est gelé, des soins médicaux immédiats doivent être recherchés.
Si le tissu n'est pas gelé, rincez les yeux immédiatement et complètement avec de grandes quantités d'eau pendant au moins 15 minutes, soulevant parfois les paupières inférieures et supérieures.
Si ce produit chimique en solution entre en contact avec la peau et ne produit pas de congélation, rincez immédiatement la peau contaminée par l'eau. Si vous pénètrez les vêtements, vérifiez-le immédiatement et lavez la peau avec de l'eau.
Peut vous servir: acide carboxyliqueSi la congélation se produit, consultez immédiatement un médecin. Les zones affectées ou le rinçage à l'eau ne doivent pas être frottées. Afin d'éviter plus de dommages causés par les tissus, vous ne devriez pas essayer d'éliminer les vêtements surgelés des zones de gel.
Si de grandes quantités de ce produit chimique sont inhalées, la personne exposée dans l'air frais doit être déplacée immédiatement. Si la respiration s'est arrêtée, faites la réanimation buccale. La victime doit être maintenue chaude et au repos, en plus d'essayer d'obtenir des soins médicaux dès que possible.
La synthèse
Le bromure d'hydrogène gazeux peut être fabriqué en laboratoire en bromant de la tétraline (1, 2, 3, 4-tétrahydronaphtalène). L'inconvénient est que la moitié du brome est perdu. Le rendement est d'environ 94%, ou ce qui est le même, 47% du brome se termine en tant que HBR.
CdixH12 + 4 BR2 → CdixH8BR4 + 4 HBR
Le bromure d'hydrogène peut également être synthétisé en laboratoire par réaction d'acide sulfurique concentré sur le bromure de sodium.
Nabr (s) + h2Swin4 → HBR (G) + NAHSO4
L'inconvénient de cette méthode est qu'une grande partie du produit est perdue en raison de l'oxydation avec un excès d'acide sulfurique pour former du brome et du dioxyde de soufre.
2 hbr + h2Swin4 → BR2 + Swin2 + 2 h2SOIT
Le bromure d'hydrogène peut être préparé en laboratoire par réaction entre l'hydrogène purifié et le brome. Ceci est catalysé par l'amiante en platine et est réalisé dans un tube de quartz à 250 ° C.
BR2 + H2[PT] → 2 HBR
Vous pouvez également produire un petit bromure d'hydrogène anhydre à petite échelle pour la thermolyse de tromure trifénylphosphonium dans le xylène au reflux.
Vous pouvez obtenir HBR à travers la méthode du phosphore rouge. Premièrement, le phosphore rouge est ajouté dans le réacteur à eau et, par la suite, lentement, le brome sous agitation et la réaction de l'acide bromhorique et de l'acide phosphore, par sédimentation, filtration et distillation obtenus seront de l'acide bromhychlorrique.
Peut vous servir: Stanislao CannizzaroP4+6 br2+12 H₂o → 12 HBR + 4 H3Pote3
Le bromure d'hydrogène préparé par les méthodes ci-dessus peut être contaminé par Br2, qui peut être éliminé en passant le gaz à travers une solution de phénol dans le tétrachlorométhane ou un autre solvant adéquat à température ambiante, produisant 2, 4, 6-tribromophénol et avec elle générant plus de HBR.
Ce processus peut également être effectué via des puces en cuivre ou de la gaze en cuivre à haute température.
Applications
- Le HBR est utilisé dans la fabrication de bromures organiques, comme le bromure de méthyle, le bromoéthane, etc., et inorganique, comme le bromure de sodium, le bromure de potassium, le bromure de lithium et le bromure de calcium, etc.
- Il est également utilisé dans des applications photographiques et pharmaceutiques ou pour la synthèse des sédatifs et des anesthésiques.
- Il est appliqué dans le séchage industriel, la finition textile, les agents de revêtement, les agents de traitement de surface et l'ignifugation.
- Il est également utilisé pour enregistrer des feuilles de polysilicio, pour la fabrication de puces informatiques.
- C'est un bon solvant pour certains minéraux métalliques, utilisés dans le raffinement métallique de haute pureté.
- Dans l'industrie pétrolière, il est utilisé comme séparation de l'alcoxi et du phénoxy.
- Il est également utilisé dans les colorants synthétiques et les épices.
- Le composé est utilisé comme réactif analytique dans la détermination du soufre, du sélénium, du bismuth, du zinc et du fer, pour la séparation de l'étain de l'arsenic et de l'antimoine. Il s'agit d'un catalyseur d'alkylation et d'un agent réducteur utilisé dans la synthèse organique.
- Il peut être utilisé pour la production d'acide bromhydrique.
- HBR est très réactif et corrosif pour la plupart des métaux. L'acide est un réactif commun en chimie organique, utilisé pour l'oxydation et la catalyse.
Les références
- Bromure d'hydrogène. Tiré de ChemicalBook.
- Fiche de données de sécurité Bromure d'hydrogène. Tiré de ScienceLab.com.

