Fondation Biuret, réactifs, procédure, utilisations
- 3708
- 311
- Lucas Schneider
Il Biuret C'est un réactif utilisé pour la détermination des protéines à longue chaîne et à chaîne courte. Il est particulièrement utilisé dans le domaine de la chimie analytique et de l'uroanalyse pour étudier la concentration des protéines totales de sérum, de plasma et d'urine.
Les valeurs des protéines peuvent être augmentées ou diminuées dans certaines pathologies. Les images d'hipoprotéinémie sont généralement présentées chez les patients atteints d'une maladie rénale, dans une malnutrition et chez des patients atteints d'infections chroniques.
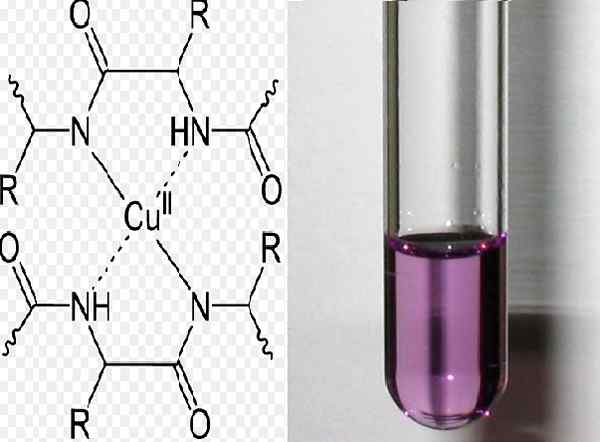
 Structure chimique du complexe formé dans la réaction de biuret Test positif Biuret. Source: Yikrazuul [Domaine public] / Flickr
Structure chimique du complexe formé dans la réaction de biuret Test positif Biuret. Source: Yikrazuul [Domaine public] / Flickr Alors que l'hyperprotéinémie est observée dans des pathologies telles que le myélome multiple, le lupus érythémateux systémique, l'endocardite bactérienne, la méningite bactérienne, la macroglobulinémie bactérienne Waldenstrom, entre autres, entre autres, entre autres, entre autres.
D'un autre côté, la présence de protéines dans l'urine est due à la filtration de l'albumine par le rein. C'est un comportement pathologique qui doit être étudié.
En ce sens, le biuret est très utile, car il permet de quantifier la présence de protéines sériques, de plasma, d'urine, entre d'autres échantillons.
Même le biuret peut être utilisé pour étudier la présence et la concentration de protéines dans des échantillons de composition inconnus ou inconnus. Par conséquent, il est largement utilisé dans le domaine de recherche.
Le test de biuret est basé sur la détection des liens peptidiques. Le test est donné en milieu alcalin. L'échantillon doit contenir au moins deux liaisons peptidiques afin qu'un complexe de couleurs de puissance violet puisse être formé. Le complexe est formé par l'union des liens et l'ion de cuivre.
[TOC]
Base
Le réactif Biuret est composé d'hydroxyde de potassium, de sulfate de cuprique et de tartrato de sodium et de potassium. L'hydroxyde de sodium est utilisé pour alcaliser l'environnement, car cette condition est indispensable pour que la réaction se produise.
Les substances qui réagissent avec les protéines sont du sulfate cuprique, tandis que le tartrato sodium a la fonction de ne pas permettre la formation d'hydroxyde de cuivre, qui a tendance à précipiter et à interférer avec la réaction.
Peut vous servir: fermentation: historique, processus, types, exemplesSi dans l'échantillon il y a des substances qui ont des liaisons peptidiques (polypeptides ou protéines), le test donnera positif.
Une réaction est interprétée comme positive lorsque la solution devient violet. La couleur est produite par la formation d'un complexe entre au moins deux liaisons peptidiques qui ont le groupe CO-NH et les cations cupriques actuelles.
Le complexe violet peut être formé de deux manières: l'une est due à la perte de protons des groupes au milieu qui se lient au métal (brouillage), et l'autre par l'union d'oxygène et d'électrons d'azote qui sont libres et qui se lient au cuivre.
Cette réaction peut varier en intensité et en couleur en fonction du type de protéine.
Le test peut être effectué qualitativement ou quantitativement. Sous la forme qualitative, il est signalé comme positif ou négatif. Tandis que sous la forme quantitative, la concentration peut être mesurée par la méthode spectrophotométrique.
La réaction est lue entre 540-560 nm. L'intensité de la couleur est directement proportionnelle à la concentration de liaisons peptidiques dans l'échantillon.
Réactifs
-Hydroxyde de sodium (NaOH) à 20%
-1% de sulfate de cupric pentahydrate (Cuo4. 5h2SOIT)
-Tartrato de potassium de sodium et de tétrahydrate de tétrahydrate (KNAC4H4SOIT6· 4h2SOIT)
Stabilité du réactif Biuret
-Il doit être conservé en réfrigération.
Procédure
Technique
-Placer 100 µl de l'échantillon ou le motif à analyser dans un tube à essai.
-Ajouter 2 ml d'hydroxyde de sodium.
-Mélanger très bien.
-Ajouter 5 ml de réactif Biuret.
-Mélanger et laisser 25 minutes à température ambiante, couvrir et protéger de la lumière.
-Observer la formation ou non de couleur et de mesurer de manière spectométrique.
Courbe d'étalonnage
Pour effectuer la courbe d'étalonnage, vous pouvez utiliser l'albumine bovine sérique comme modèle. Plusieurs concentrations en sont préparées. Par exemple 25, 50, 75, 100, 125 et 150%.
La réaction est montée avec toutes ces concentrations connues et l'absorbance est lue sur une longueur d'onde de 540 nm. Avec les données des concentrations connues et des lectures d'absorption, la courbe d'étalonnage est effectuée.
Il peut vous servir: flore et faune de la Chine: espèces représentativesDans chaque détermination ou beaucoup d'échantillons traités, il est conseillé. En tant que modèle d'étalonnage, vous pouvez utiliser l'albumine bovine sérique 0,1-2 mg / ml.
Les mesures sont effectuées dans un spectrophotomètre de 540 nm.
La linéarité est remplie jusqu'à une concentration de 12 g / dl.
Ingérence
Substances qui interfèrent dans le test de biuret
Bien qu'il ne soit pas très fréquent, il convient de noter que lors de l'exécution de ce test, certaines substances peuvent intervenir. Par exemple, la présence d'ammonium peut inhiber la formation de couleurs.
De même, d'autres substances pourraient absorber la même longueur d'onde, comme certains pigments.
D'un autre côté, une interférence peut être générée lorsqu'une autre substance autre que la liaison peptidique forme un complexe avec du sel métallique. Exemple: certains glucides et certains lipides.
Dans le cas où il le montre pour analyser un certain type de précipité, il doit être filtré ou centrifugé avant de configurer le test.
Substances qui n'interfèrent pas dans le test de biuret
Le test n'est pas affecté par la présence de:
-Bilirubine jusqu'à une concentration de 20 mg / dl.
-Hémoglobine à une concentration de 750 mg / dl.
-Dextrane à une concentration de 30 g / L.
-Triglycérides jusqu'à une concentration de 4000 mg / dl.
avantage
-C'est une méthode simple d'exécution.
-C'est un test économique.
-Il a une spécificité élevée en protéines.
-Peu d'interférence.
Désavantages
Il a peu de sensibilité pour détecter de faibles quantités de protéines. Le travail effectué par Fuentes et les collaborateurs affirme que la méthode de test Biuret a une limite de détection de 1 mg / ml de la protéine et une limite de quantification de 3 mg / ml.
Cependant, une autre recherche menée à l'Université d'Amazon rapporte des valeurs beaucoup plus faibles. La limite de détection selon laquelle l'étude rapporte est de 0,020 mg / ml et la limite de quantification de 1.33 mg / ml.
Applications
Le réactif ou le test de biuret est utilisé pour la détermination des protéines dans les échantillons cliniques et non cliniques dans les laboratoires de routine et de recherche.
Peut vous servir: caractéristiques des êtres vivantsPathologies qui étudient ou diminuaient Protéines
Dans de nombreuses pathologies, il est important de déterminer la concentration de protéines totales dans les échantillons cliniques, en mesure d'être élevé ou diminué.
Ils sont élevés dans:
-Myélome multiple,
-Le lupus érythémateux disséminé,
-Endocardite bactérienne,
-Méningite bactérienne,
Waldestrom macroglobulinémie, entre autres.
Il est diminué dans:
-Insuffisance rénale,
-Les personnes souffrant de malnutrition sévère,
-Les patients atteints d'infections chroniques, entre autres.
Échantillons cliniques
Les échantillons cliniques les plus courants sont le sérum, le plasma et l'urine. La valeur normale des protéines sériques ou plasmatiques est 6.0-8.8 gr / dl.
La concentration en protéines chez l'adulte chez l'adulte ne dépasse pas le chiffre de 150 mg / 24 heures.
Valeur normale de l'indice des protéines urinaires / créatinine dans l'urine
Nourrissons: < a 0,50 mg
Enfants de 2 ans et plus: Index: 0,20 mg
Adultes: < 0,2 mg
Échantillons non cliniques
La réaction Biuret peut être utilisée pour de nombreux types d'échantillons non cliniques, tels que les produits laitiers, les sérums antiophiques ou toute substance inconnue à laquelle la présence de protéines est vouée.
Les références
- Vázquez J, Guerra L, Quintana J, Ramírez J, Fernando Ry Vázquez et. (2014). Caractérisation chimique physique et teneur en protéines des extraits de fluide de mangrove austrion (crassostrearizophorae). Journal cubain de chimie, 26 (1), 66-74. Récupéré le 26 juin 2019 de http: // SCIELO.SLD
- Chaparro S, Lara A, Sandoval A, Sosa S, Martínez J, Gil J. Caractérisation fonctionnelle des amandes de graines de mangue (Mangifera indique L.) Magazine Science du développement. 2015; 6 (1): 67-75
- "Biuret." Wikipedia, encyclopédie gratuite. 19 juin 2019, 16:37 UTC. 26 juin 2019, 22:18
- Fuentes F, QUISTE I, GARCía J. Biuret Méthode Standardisation pour quantifier les protéines totales dans le sérum antibotrope polyvalent produit au National Biological Products Center. Bol - Inst Nac Health 2012; 18 (11-12). Disponible sur: Référentiel.Insouffisants.Gueule.pe
- Laboratoires Winer. Total des protéines. Méthode colorimétrique pour déterminer les protéines sériques et plasmatiques totales. Disponible sur: wiener-lab.com.ardente
- « Teocalli ce qui est, fonction et signification
- Caractéristiques du microscope à champ sombre, pièces, fonctions »

