Caractéristiques de la bêta-galactosidase, structure, fonctions
- 2107
- 157
- Prof Ines Gaillard
La Bêta-galactosidase, La β-galactosidase ou le β-D-galactohydrolyse est une enzyme appartenant à la famille des hydrolases de glycosil capable d'hydrolyzer les déchets galactosyles de différents types de molécules: polymères, oligosaccharirides et métabolites secondaires, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres, entre autres: les polymères, les oligosaccharirides et les métabolites secondaires.
Auparavant connu sous le nom de "lactase", sa distribution, ainsi que celle des polysaccharides oligo- et β-galactosité qui servent de substrat, est extrêmement large. Il se trouve dans les bactéries, les champignons et les levures; Dans les plantes, il est courant dans les amandes, les pêches, l'abricot et les pommes, et chez les animaux, il est présent dans des organes tels que l'estomac et les intestins.
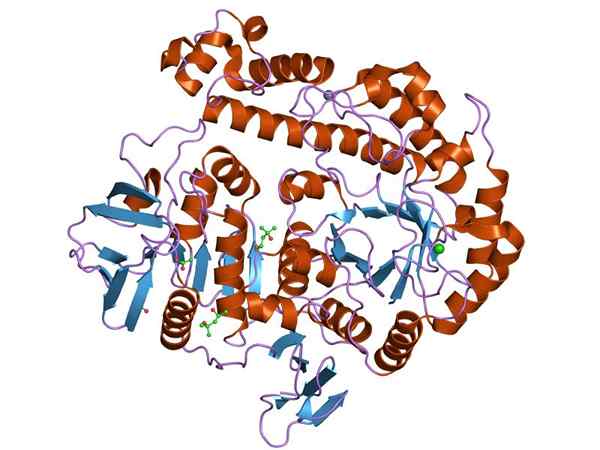
 Représentation graphique de la structure de l'enzyme de la B-galactosidase (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons)
Représentation graphique de la structure de l'enzyme de la B-galactosidase (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons) L'enzyme la plus étudiée est celle de l'Opeon LAC de ET. coli, Gen encodé Lacz, dont les études ont été essentielles pour comprendre le fonctionnement des opérations génétiques et de nombreux aspects régulateurs.
Il appartient actuellement au meilleur groupe enzymatique étudié et leur fonction la plus connue est celle de l'hydrolyse des liens glucosidiques du lactose. Il remplit les fonctions métaboliques essentielles dans les organismes qui l'expriment et sont également utilisés à des fins industrielles différentes.
Parmi les applications industrielles, il y a l'élimination du lactose des produits laitiers pour les personnes intolérantes au lactose et la production de plusieurs composés de galactosité. Ils sont également utilisés pour améliorer la douceur, le goût et la digestion de nombreux produits laitiers.
[TOC]
Caractéristiques
En plus des substrats de la galactosité tels que le lactose, la plupart des β-galactosidases connues nécessitent des ions métalliques divalents tels que le magnésium et le sodium. Cela a été prouvé avec la découverte de sites syndicaux pour ces métaux dans sa structure.
Les β-galactosidas présents dans la nature ont une grande variété de gammes de pH auxquelles ils peuvent travailler. Les enzymes fongiques fonctionnent dans des environnements acides (2.5 à 5.4), tandis que les levures et les bactéries fonctionnent entre 6 et 7 unités de pH.
Peut vous servir: bactéries à Gram négatifβ-galactosidas bactériens
Les bactéries ont de grandes enzymes galato-hydrolytiques par rapport aux autres galactosides analysés. Dans ces organismes, la même enzyme catalyse trois types de réactions enzymatiques:
- Hydrolyza lactose à ses monosaccharides constitutifs: galactose et glucose.
- Catalyse la transgastilation du lactose à l'alolactose, un sucre disaccharide qui participe à la régulation positive de l'expression des gènes appartenant à l'opéone LAC, Eç.
- Hydrolyse l'alolactose similaire à la façon dont il fait avec le lactose.
β-galactosidas fongique
Les champignons ont des enzymes β-galactosidase plus sensibles à l'inhibition du galactose que les enzymes appartenant à d'autres organismes. Cependant, ceux-ci sont thermostables et fonctionnent dans des plages de pH acides.
Le métabolisme du lactose médié par ces enzymes dans les champignons est divisé en extracellulaire et cytosolique.
Structure
L'enzyme de la β-galactosidase des bactéries est une enzyme tétramérique (de quatre sous-unités identiques, A-D) et chacun de ses monomères en a plus de 1.000 déchets d'acides aminés, ce qui signifie un poids moléculaire de plus de 100 kDa pour chacun et plus de 400 kDa pour la protéine complexe.
Dans les plantes, au contraire, l'enzyme est considérablement plus petite et peut être couramment trouvée comme un dimère de sous-unités identiques.
Les domaines de chaque monomère se distinguent avec les nombres de 1 à 5. Le domaine 3 a une structure de baril α / β «TIM» et a le site actif à l'extrémité C-terminale du baril.
Peut vous servir: organogenèse animale et végétale et ses caractéristiquesIl est présumé que les sites actifs du complexe enzymatique sont partagés entre les monomères, donc cette enzyme est biologiquement active uniquement lorsqu'elle est complexée comme un tétramètre.
Son site actif a la capacité de rejoindre le D-glucosa et le d-galactose, les deux monosaccharides qui composent le lactose. Il est particulièrement spécifique au d-galactose, mais ce n'est pas tant pour le glucose, donc l'enzyme peut agir sur d'autres galactosides.
Les fonctions
Dans les animaux
Dans l'intestin de l'homme, la fonction principale de cette enzyme a à voir avec l'absorption du lactose ingéré avec de la nourriture, car elle est située sur la face luminale de la membrane plasmique des cellules intestinales sous forme de forme de pinceau.
De plus, il a été démontré que les isoformes lysosomales de cette enzyme participent à la dégradation de nombreux glucolipides, mucopolysaccharides et glycoprotéines galactosité, qui a plusieurs objectifs sur différentes voies cellulaires.
Dans les plantes
Les plantes ont des enzymes β-galactosidase sur les feuilles et les graines. Ceux-ci remplissent des fonctions importantes dans le catabolisme des galactolipides, qui sont caractéristiques des algues et des plantes en général.
Dans ces organismes, la β-galactosidase participe aux processus de croissance des plantes, de maturation des fruits et, dans les plantes supérieures, il s'agit de la seule enzyme connue capable d'hydrolyzer les déchets galactosyles des polysaccharides de la paroi cellulaire de la paroi cellulaire.
Dans l'industrie et la recherche
Dans l'industrie alimentaire liée aux produits laitiers, l'enzyme β-galactosidase est utilisée pour catalyser l'hydrolyse du lactose présent dans les produits laitiers, qui est responsable de nombreux défauts liés au stockage de ces produits.
L'hydrolyse de ce sucre cherche à éviter la sédimentation des particules, la cristallisation des desserts laitiers congelés et la présence de textures «sablonneuses» dans la plupart des dérivés commerciaux du lait.
Peut vous servir: la chaîne alimentaire de la Terre: liens et exempleLa β-galactosidase utilisée industriellement est obtenue, généralement, du champignon Aspergillus sp., Bien que l'enzyme produite par la levure Kluyveromyces lactis Il est également largement utilisé.
L'activité de la β-galactosidase, qui se traduit par des termes scientifiques tels que la «fermentation du lactose», est systématiquement testé pour l'identification des entérobactéries Gram négatives présentes dans différents types d'échantillons.
De plus, en termes médicaux, il est utilisé pour la production de produits laitiers sans lactose et pour la formulation de comprimés utilisés par les personnes intolérantes au lactose pour digérer le lait et leurs dérivés (yaourt, fromage, crème glacée, beurre, crèmes, etc.).
Il est utilisé comme «biocapteurs» ou «biomarqueur» avec la diversité des objectifs, des immunoessais et de l'analyse toxicologique à l'analyse de l'expression des gènes et du diagnostic des pathologies grâce à l'immobilisation chimique de cette enzyme dans des supports spéciaux dans des supports spéciaux.
Les références
- Henrissat, b., & Daviest, G. (1997). Classification structurelle et basée sur les séquences des hydrolas glycosides. Biologie actuelle, 7, 637-644.
- Huber, R. (2001). Bêta (b)-galactosidase. Presse universitaire, 212-214.
- Husain, Q. (2010). β Galactosidaese et leurs applications potentielles: une revue. Revues critiques en biotechnologie, 30, 41-62.
- Juge, D. H., Matthews, B. W., & Huber, R. ET. (2012). LACZ B-galactosidase: structure et fonction d'une enzyme d'importance biologique historique et moléculaire. Protéine scientifique, vingt-et-un, 1792-1807.
- Lee, B. ET., Han, J. POUR., Im, J. S., Morrone, un., Johung, k., Goodwin, C.,… Hwang, et. S. (2006). La β-galactosidase asocée par la sénescence est la β -gastosidase lysosomale. Cellule vieillissante, 5, 187-195.
- Matthews, B. W. (2005). La structure de e. β-galactosidase coli. C. R. Biologies, 328, 549-556.
- McCarter, J. D., & Withers, s. g. (1994). Mécanismes d'hydrolyse enzymatique du glycoside. Opinion actuelle en biologie structurelle, 4, 885-892.
- Richmond, M., Gray, J., & Stine, C. (1981). La bêta-galactosidase: examen du CHECT récent lié à l'application technologique, aux préoccupations nutritionnelles et à l'immobilisation. J Dairy Sci, 64, 1759-1771.
- Wallenfels, k., & Weil, R. (1972). B-galactosidase.
- « Caractéristiques de la méthode du coût minimum, avantages, inconvénients
- Méthode hongroise Ce qui consiste, exemple »

