Historique du béryllium, structure, propriétés, utilisations

- 803
- 19
- Louna Baron
Il béryllium C'est un élément métallique qui appartient au groupe 2 ou à l'IIA du tableau périodique. C'est le métal alcalin le plus léger du groupe, et est représenté par le symbole be. Son atome et son cation sont également plus petits que ceux de leurs pairs (Mg, CA, MR ...).
En raison de sa densité de charge inhabituelle, ce métal ne se produit généralement pas isolément. Ils connaissent environ 30 minéraux qui le contiennent, parmi lesquels sont: le beryl (3beo · al2SOIT3· 62· 2h2O), le Bertrandita (4beo.22.2h2O), El Chrisoberilo (Beal2SOIT4), et le Fenaquita (être2Ouais4).
 Pipetas de Beryll métallique. Source: W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Pipetas de Beryll métallique. Source: W. Oelen [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] La Esmeralda, une pierre précieuse, est une variante du Beryl. Cependant, le béryllium pur n'est pas si frappant; Il a l'air d'une luminosité grisâtre pâle (image supérieure), et a été réalisée sous la forme de pepitas ou de drages.
Le béryllium a un ensemble de propriétés physiques caractéristiques. Il a une faible densité; comportement thermique et électrique élevé, ainsi que sa capacité thermique et sa dissipation thermique; Ce n'est pas un métal magnétique; et a également une combinaison appropriée de rigidité et d'élasticité.
Toutes ces propriétés ont conduit le béryllium à être un métal avec de nombreuses applications, allant de son utilisation dans les alliages de cuivre pour l'élaboration des outils, à son utilisation dans les fusées, les avions, .
Le béryllium a 10 isotopes connus, allant de 5Être un 14Être, être le 9Être le seul stable. Il s'agit également d'un métal très toxique, qui affecte particulièrement le système respiratoire, il y a donc une limitation dans son utilisation.
[TOC]
Historique de votre découverte
Le béryllium a été découvert par Louis-Nicolas Vauguelin en 1798 en tant qu'élément de composition du Berilo Mineral, et un silicate d'aluminium et de béryllium.
Par la suite, le chimiste allemand Frédéric Wöhler, en 1828, a réussi à isoler le béryllium en réagissant au potassium avec du chlorure de béryllium dans un pot en platine.
Simultanément et indépendamment, le chimiste français Antoine Bussy a également réalisé l'isolement du béryllium. Wöhler a été le premier à suggérer le nom du béryllium pour le métal.
Il a reçu son nom actuel en 1957, car il était auparavant connu sous le nom de gluciinium, en raison du goût sucré de certains sels. Mais, pour éviter la confusion avec d'autres composés de goût sucré, et avec une plante appelée glucina, il a été décidé de changer le nom du béryllium.
Structure bouillante
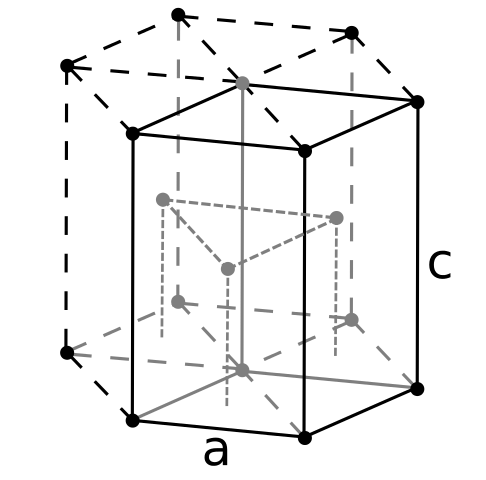 Structure de bouffée. Source: utilisateur: dornelf [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Structure de bouffée. Source: utilisateur: dornelf [cc by-sa 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] Étant béryl le plus léger des métaux alcalinoterrus, il faut s'attendre à ce que le volume de ses atomes soit le plus petit de tous. Les atomes de bérylil interagissent entre eux par la liaison métallique, de sorte que leur "mer d'électrons" et les répulsions entre les noyaux modélisent la structure en verre résultante.
Il peut vous servir: acide périódique (HIO4): qu'est-ce que la structure, les propriétés, les utilisationsLes cristaux noirs de béryllium sont ensuite formés. Ces cristaux ont une structure hexagonale (image supérieure), où chacune est six voisins latéraux, et trois autres dans les plans de haut et de bas.
Étant des cristaux noirs, c'est utile. C'est l'une des structures les plus compactes qu'un métal peut adopter; Et il est logique que les si petits atomes de "serrer" à la fois pour éviter le moins de vide ou de nombre de trous entre eux.
Configuration électronique
122s2
Ce qui est égal à 4 électrons, dont 2 sont de Valence. Si un électron à l'orbitale 2p est promu, deux orbitales SP Hbíbridos auront. Ainsi, dans les composés de béryllium, il peut y avoir des géométries linéaires, X-Be-X; Par exemple, la molécule Becl isolée2, Cl-be-cl.
Propriétés
Description physique
Couleur gris, brillant et fragile solide.
Point de fusion
1287 ºC.
Point d'ébullition
2471 ºC.
Densité
- 1 848 g / cm3 à température ambiante.
- 1,69 g / cm3 au point de fusion (état liquide).
Radio atomique
23h.
Radio-covalent
21 h.
Volume atomique
5 cm3/ mol.
Chaleur spécifique
1 824 J / g · mol à 20 ºC.
Chaleur de fusion
12.21 kJ / mol.
Chaleur d'évaporation
309 kJ / mol.
Électronégativité
1.57 sur l'échelle Pauling.
Potentiel standard
1,70 V.
Vitesse du son
12.890 m / s.
Dilatation thermique
11,3 µm / m · k à 25 ° C.
Conductivité thermique
200 w / m · k.
Propriétés chimiques
Le béryllium est recouvert d'une couche d'oxyde de beryl (BEEO) qui sert de protection de l'air à température ambiante. L'oxydation du béryllium se produit à des températures supérieures à 1000 ºC, provenant de produits d'oxyde de béryllium et de nitrure de béryllium.
Il est également résistant à l'action de l'acide nitrique 15 m. Mais, il se dissout dans l'acide chlorhydrique et les alcalis, comme l'hydroxyde de sodium.
Applications
Préparation des outils
Le béryllium forme des alliages avec du cuivre, du nickel et de l'alumin. En particulier, l'alliage avec le cuivre produit des outils de grande dureté et de la résistance, ne constituant que 2% du poids de l'alliage.
Ces outils ne produisent pas d'étincelles lors de la frappe du fer, ce qui leur permet une utilisation dans des environnements avec une teneur élevée de gaz combustibles.
Peut vous servir: thermique: structure, caractéristiques, formation, exemplesEn raison de sa faible densité, il a un poids léger qui, avec sa rigidité, permet son utilisation dans les avions spatiaux, les fusées, les missiles et les avions. L'alliage avec du béryllium a été utilisé dans l'élaboration des pièces automobiles. Il a également été utilisé dans l'élaboration des ressorts.
En raison de la grande dureté conférée par le béryllium à ses alliages, ceux-ci ont été utilisés sur les freins des avions militaires.
Élaboration des miroirs
Le béryllium a été utilisé dans la production de miroirs en raison de sa stabilité dimensionnelle et de sa capacité à avoir une pulte élevée. Ces miroirs sont utilisés dans les satellites et les systèmes de contrôle des incendies. De plus, des télescopes spatiaux sont utilisés.
Dans les rayonnements ionisants
Le béryllium est un élément de faible densité, il peut donc être considéré comme transparent aux rayons x. Cette fonctionnalité permet son utilisation dans la construction des fenêtres des tubes qui produisent des rayons X, une application industrielle et un diagnostic médical.
De même, le béryllium est utilisé dans les fenêtres des détecteurs d'émission radioactifs.
Dans les équipes de génération de magnétisme
Parmi les caractéristiques du béryllium, n'est pas un élément magnétique. Cela lui permet d'être utilisé dans la construction d'articles d'équipement de résonance magnétique, dans lequel des champs magnétiques d'une grande intensité sont générés, minimisant toute interférence.
Réacteurs nucléaires
En raison de son point de fusion élevé, il a trouvé une application dans les réacteurs nucléaires et la céramique. Le béryllium est utilisé comme modérateur des réactions nucléaires et comme producteur à neutrons:
9Être + 4Il (α) => 12C + N (neutron)
On estime que pour un million d'atomes de beryl qui sont bombardés avec des particules α, jusqu'à 30 millions de neutrons se produisent. Précisément cette réaction nucléaire a permis la découverte du neutron.
James Chadwick a bombardé des atomes de béryllium avec des particules α (il). Le chercheur a observé la libération de particules subátomiques, sans charge électrique, qui a conduit à la découverte de neutrons.
Protecteur de métal
Ajoutez une quantité de béryllium à la surface des métaux qui peuvent être oxydés, confère une certaine protection. Par exemple, l'inflammabilité du magnésium est réduite et la luminosité des alliages d'argent est prolongée.
Où est-il situé?
Le beryl se trouve dans la pegmatite, associé au mica, au feldspath et au quartz. Grâce à l'utilisation d'une technique de flottation, il est possible de séparer un mélange de beryl et de feldspath. Par la suite, le feldspath et le beryl sont concentrés et soumis à un traitement avec de l'hypochlorite de calcium.
Il peut vous servir: différences entre les composés organiques et inorganiquesSuivi d'un traitement avec de l'acide sulfurique et du sulfonate de potassium, par dilution, la flottation du béryl est obtenue, la séparant du feldspath.
Le beryl est traité avec du fluorosyle de sodium et de la soude à 770 ºC pour former du fluorobérilate de sodium, de l'oxyde d'aluminium et du dioxyde de silicium. Ensuite, l'hydroxyde de béryllium de la solution de fluorroberile d'hydroxyde de sodium est précipité.
Le fluorure de béryllium est formé en réagissant à l'hydroxyde de beryl avec du fluorure d'hydrogène ammoniacal, produisant de l'ammonium ammonium. Ceci est chauffé pour former du fluorure de béryllium, qui est traité avec du magnésium chaud pour isoler le béryllium.
Des risques
Le béryllium comme métal finement divisé, sous forme de solutions, de poussière sec ou de fumée, est très toxique et peut produire une dermatite. Cependant, la plus grande toxicité est produite par inhalation.
Initialement, le béryllium peut induire une hypersensibilité ou une allergie, qui peut devenir une belliose ou une maladie chronique du béryllium (CBD). Il s'agit d'une maladie grave, caractérisée par une diminution de la capacité pulmonaire.
La maladie aiguë est rare. Dans la maladie chronique, il y a la formation de farulome dans tout le corps, en particulier dans les poumons. La belliose chronique provoque une dyspnée progressive, une toux et une faiblesse générale (Asthénie).
La belliose aiguë peut être mortelle. Dans la belliose, la perte progressive de la fonction respiratoire se produit, car il y a une obstruction dans le flux des voies respiratoires dans les voies respiratoires et une diminution de l'oxygénation de la pression artérielle du sang.
Les références
- Société royale de chimie. (2019). Béryllium. Récupéré de: RSC.org
- Centre national d'information sur la biotechnologie. (2019). Béryllium. Base de données PubChem. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Helmestine, Anne Marie, Ph.D. (15 mars 2019). Faits de béryllium. Récupéré de: Thoughtco.com
- Wikipédia. (2019). Béryllium. Récupéré de: dans.Wikipédia.org
- Lentech b. V. (2019). Béryllium-be. Récupéré de: lentech.com
- Matériel d'entreprise. (2019). Découvrez l'élément de béryllium récupéré de: Beryllium.com
- D. Michaud. (12 avril 2016). Problème de traitement et d'extraction du béryllium. 911 Métallurgiste. Récupéré de: 911metallurgist.com
- Timothy P. Hanusa. (5 janvier 2016). Béryllium. Encyclopædia Britannica. Récupéré de: Britannica.com
- Lire S. Homme nouveau. (2014). Maladie du béryllium. Manuel MSD. Récupéré de: msdmanuals.com
- « Histoire, objectifs et profils de la psychologie du sport
- Globalisation socialisation Dimension sociale, avantages et exemples »

