Histoire du benzène, structure, propriétés, dérivés, utilisations

- 5031
- 925
- Jade Duval
Il benzène C'est un composé organique qui se compose de l'un des hydrocarbures aromatiques les plus simples. Sa formule chimique est C6H6, dont on sait que la relation entre le carbone et l'hydrogène est égale à 1; c'est-à-dire que pour chaque carbone, il y a un hydrogène lié à cela.
Bien que son apparence physique soit celle d'un liquide incolore, il se trouve naturellement dans l'huile et les produits en dérive. Son odeur est très caractéristique, car elle ressemble à un mélange de colle, de bitume et d'essence; D'un autre côté, c'est un liquide volatil et inflammable.
 Belfing avec benzène. Source: Air1404 [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)]
Belfing avec benzène. Source: Air1404 [CC par 4.0 (https: // CreativeCommons.Org / licences / par / 4.0)] Dans l'image supérieure, un récipient ou une bouteille avec du benzène est illustré, vraisemblablement de pureté non analytique. Si les vapeurs de benzène sont immédiatement découvertes dans tout le laboratoire. Pour cette raison, ce liquide, couramment utilisé comme solvant simple, est manipulé à l'intérieur d'une cloche d'extracteur à gaz.
Être votre Formule C6H6, Les produits chimiques du XIXe siècle ont soulevé de nombreuses structures possibles qui correspondent à ladite proportion c / h égale à 1. Non seulement cela, mais la molécule de benzène devait avoir des liens spéciaux de manière à ce que sa stabilité inhabituelle puisse s'expliquer aux réactions d'addition; Typique pour les alcènes et les politiques.
C'était ainsi que ses liens représentaient une énigme pour les produits chimiques de l'époque; Jusqu'à ce que la propriété appelle aromaticité. Avant considéré comme un hexacycotriène (avec trois liaisons c = c), le benzène est bien plus que cela, et c'est un autre des nombreux exemples de synergie en chimie.
En chimie organique, le benzène est un symbole classique, base structurelle pour plusieurs composés polylaromatiques. De son hexagone, des symphines de dérivés sont obtenues par substitution électrophile aromatique; Un anneau dont les bords borde la structure qui définit les nouveaux composés.
En fait, ses dérivés doivent les vastes utilisations industrielles pour ceux qui ont besoin de benzène parmi leur matière première. De la préparation de la colle textile et des fibres aux plastiques, caoutchoucs, pigments, drogues et explosifs. D'un autre côté, le benzène naturellement se trouve dans les volcans, les incendies de forêt, l'essence et la fumée des cigarettes.
[TOC]
Histoire
Découverte et noms
Sa découverte remonte à 1825, normalement décernée à Michael Faraday, lorsqu'il a collecté et fait des expériences avec un produit pétrolier restant du gaz utilisé pour l'éclairage. Ce liquide contenait une proportion C / H près de 1, c'est pourquoi elle l'a appelée «hydrogène carburé».
Le chimiste Auguste Laurent a nommé l'étrange hydrocarbure «phéno», dérivé du mot grec »Phaínein`` Ce qui signifie brillant (car il a été obtenu après le gaz brûlé). Cependant, ce nom n'a pas été accepté par la communauté scientifique et n'a prévalu que comme «phényle», pour se référer aux radicaux dérivés du benzène.
Depuis le caoutchouc de benoin, le chimiste Eilhard Mitscherlich, neuf ans plus tard, a réussi à produire le même composé; Il y avait donc une autre source pour les mêmes hydrocarbures, qu'il a baptisés comme «Benzina». Cependant, ils n'ont pas non plus considéré le nom approprié pour supposer qu'il s'agissait d'un alcaloïde, comme la quinine.
Ainsi, ils ont remplacé le nom «Bencina» par «Benzol». Cependant, il y avait à nouveau des contradictions et des écarts parce que le terme hydrocarbure confus «Benzol» pour un alcool. C'est alors que le nom «Benzène» est né, utilisé d'abord en France et en Angleterre.
Il peut vous servir: carbonate de lithium (LI2CO3): structure, propriétés, utilisationsProduction industrielle
Ni l'éclairage du gaz ni de la gomme de benjoin n'étaient des sources appropriées pour générer du benzène à grande échelle. Charles Mansfield, en collaboration avec August Wilhelm von Hofmann, atteint en 1845 Isolat the Benzène (vingt ans après sa découverte) du Tar Hulla, produit latéral de la production de coke.
Ainsi, la production industrielle de benzène a commencé de la Hulla Tar. La disponibilité du benzène en quantités massives, a facilité l'étude de ses propriétés chimiques et lui a permis de la relier à d'autres composés de réactivités similaires. August Wilhelm von Hofmann a inventé le mot «aromatique» pour le benzène et les composés connexes.
Structures historiques
Le rêve de August Kekulé
Friedrich August Kekulé reçoit la structure hexagonale et cyclique du benzène vers 1865, découlant d'un rêve étrange avec Uroboros, le serpent qui mord sa propre queue en dessinant un cercle. Ainsi, il pensait que le benzène pouvait être considéré comme un anneau hexagonal, et d'autres produits chimiques soulevés des structures possibles, qui sont illustrées ci-dessous:
 Structures d'anneau de benzène proposées à travers l'histoire. Source: Jü [domaine public]
Structures d'anneau de benzène proposées à travers l'histoire. Source: Jü [domaine public] Certaines des structures supérieures pourraient justifier la stabilité du benzène.
Livre, anneaux et prisme
Notez que la troisième structure n'est même pas un anneau mais un prisme triangulaire, proposé par Albert Ladenburg en 1869; À sa gauche, un livre ouvert en forme, proposé par Sir James Dewar en 1867; Et à sa droite, un avec tous les hydrogènes dirigés vers le centre de l'anneau, proposé par Henry Edward Armstrong en 1887.
La première structure, proposée par Adolf Karl Ludwig Claus en 1867, est également assez particulière, car les liens C-C sont traversés. Et le dernier était la bague "serpentine" de Kekulé, rêvait en 1865.
Quel a été le "gagnant"? La cinquième structure (de gauche à droite), proposée en 1899 par Johannes Thiele.
In this, the resonance hybrid was considered for the first time, which combined the two Kekulé structures (turned the first ring on the right to observe it) and explained extraordinarily the relocation of the electrons and, with it, the until then unusual stability of le benzène.
Structure de benzène
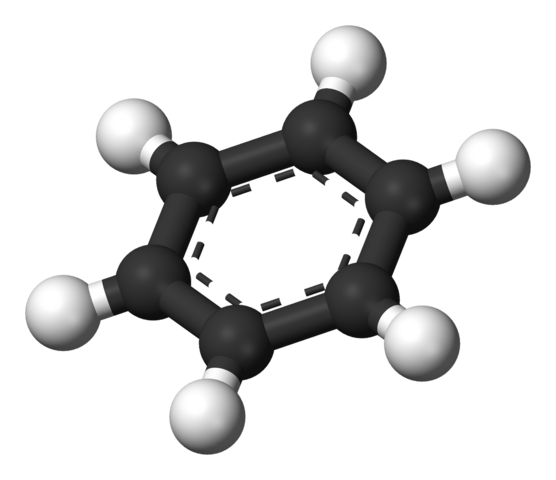 Benzène aromatique. Source: Benjah-Bmm27 [domaine public]
Benzène aromatique. Source: Benjah-Bmm27 [domaine public] La structure proposée par Thiele est montrée par un modèle de sphères et de barres.
La molécule de benzène est plate, les atomes d'hydrogène pointant des côtés de l'anneau. Tous les atomes de carbone ont une hybridation SP2, Avec une orbitale p Disponible pour établir le système aromatique dans lequel six électrons déménagent.
Ces carbonos sp2 Ils sont plus électronégatifs que les hydrogènes, et par conséquent, le premier supprime la densité électronique à ce dernier (CSP2δ--Hδ+). Par conséquent, le centre de l'anneau a une plus grande concentration d'électrons que ses côtés.
Plus précisément, le système aromatique peut être représenté comme un nuage ou un coussin électronique dilaté par les deux côtés de l'anneau hexagonal; et au milieu, par les côtés ou les bords, une carence électronique formée par des hydrogènes avec une charge partielle positive.
Grâce à cette distribution des charges électriques, les molécules de benzène peuvent interagir entre elles par des forces dipol-dipolo; Les atomes hδ+ Ils ressentent une attirance pour le centre aromatique d'un anneau voisin (en dessous de cela sera représenté).
De même, les centres aromatiques peuvent être empilés les uns sur les autres pour favoriser l'induction de dipôles instantanés.
Peut vous servir: alotropieRésonance
 Structures et hybride de résonance du benzène. Source: Edgar181 de Wikipedia.
Structures et hybride de résonance du benzène. Source: Edgar181 de Wikipedia. Les deux structures Kekulé sont montrées en haut de l'image, et sous elles, l'hybride de résonance. Alors que les deux structures se produisent encore et encore en même temps, l'hybride est représenté avec un cercle dessiné au milieu (similaire à celui d'un "beignet hexagonal").
Le cercle hybride est important car il indique le caractère aromatique du benzène (et celui de nombreux autres composés). De plus, il souligne que les liens ne sont pas aussi longs que c-c, ni aussi courts que c = c; Mais leur longueur est entre les deux extrémités. Ainsi, le benzène n'est pas considéré comme un polyhene.
Ce qui précède a été démontré par la mesure des longueurs des liaisons C-C (139 h) du benzène, qui sont un peu plus allongées que les liaisons C-H (109 h).
Cristaux
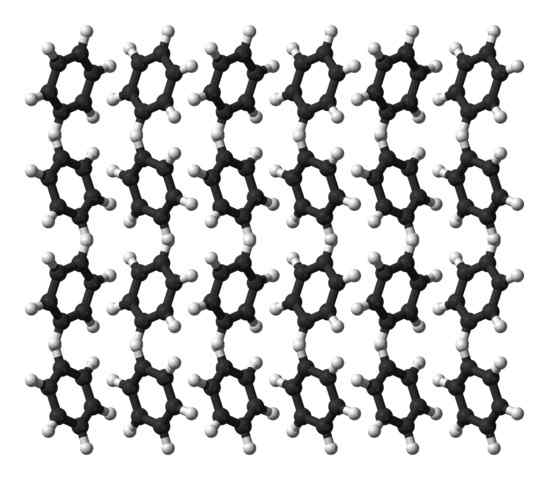 Benzène Ortorrombic Crystal Structure. Source: Ben Mills [domaine public]
Benzène Ortorrombic Crystal Structure. Source: Ben Mills [domaine public] Le benzène est un liquide à température ambiante. Ses forces intermoléculaires font, malgré un moment dipolaire aussi prononcé, il peut garder ses molécules ensemble dans un liquide qui bout à 80 ° C. Lorsque la température tombe en dessous de 5 ° C, le benzène commence à geler: et donc leurs cristaux correspondants sont obtenus.
Les anneaux de benzène peuvent adopter des schémas structurels définis dans leur solide. Leurs dipôles les rendent "inclinés" à gauche ou à droite, formant des rangs capables de se reproduire par une cellule orthorm orthorm. Ainsi, les cristaux de benzène sont ortorrombiques.
Notez dans l'image supérieure que lorsque les anneaux sont enclins à favoriser les interactions entre le Hδ+ et les centres aromatiques, mentionnés dans les sous-sections précédentes.
Propriétés
Masse moléculaire
78 114 g / mol.
Apparence physique
Liquide incolore avec une odeur similaire à l'essence.
Point d'ébullition
80ºC.
Point de fusion
5,5 ° C.
point d'allumage
-11 ° C (tasse fermée).
Température d'auto-signification
497,78ºC.
Densité
0,8765 g / ml à 20 ° C.
Solubilité
Un litre d'eau bouillante peut à peine dissoudre 3,94 g de benzène. Son caractère apolaire le rend pratiquement non miscible avec l'eau. Cependant, il est miscible avec d'autres solvants, tels que l'éthanol, les éthers, l'acétone, les huiles, le chloroforme, le tétrachlorure de carbone, etc.
Densité de vapeur
2.8 dans la relation aérienne (c'est-à-dire presque trois fois plus).
La pression de vapeur
94,8 mm Hg à 25ºC.
Chaleur de combustion
-3267,6 kJ / mol (pour le benzène liquide).
Chaleur de vaporisation
33,83 kJ / mol.
Tension superficielle
28,22 MN / m A 25ºC.
Indice de réfraction
1 5011 à 20 ° C.
Dérivés

Les hydrogènes de benzène peuvent être remplacés par d'autres groupes ou atomes. Il peut y avoir une ou plusieurs substitutions, augmentant le degré de substitution jusqu'à ce que les six hydrogènes d'origine y soient.
Par exemple, Benceno en tant que ph-H, où H est l'un de ses six hydrogènes. Rappelant que le centre de l'anneau a une plus grande densité électronique, attire des électrophiles, qui attaquent l'anneau pour remplacer H dans une réaction appelée substitution électrophile aromatique (Sear).
Si ce H est remplacé par un OH, le ph-oh, le phénol aura lieu; Remplacer un cho3, Ph-ch3, Toluène; Si c'est NH2, Ph-nh2, aniline; Ou si c'est le cho2Ch3, Ph-ch2Ch3, Éthylbenzène.
Les dérivés peuvent être identiques ou plus toxiques que le benzène, ou au contraire, de devenir si complexes qu'ils deviennent un effet pharmacologique souhaitable.
Peut vous servir: carbure de calcium (CAC2): structure, propriétés, obtention, utilisationsApplications
C'est un bon solvant pour une grande variété de composés, présents par exemple dans les peintures, les vernis, les adhésifs et les revêtements.
Il peut également dissoudre les huiles, les graisses ou les cires, il a donc été utilisé comme solvant d'extracteur d'essence. Cette propriété a été utilisée par Ludwig Roselius en 1903 pour décaféinez le café, une opération déjà en désuétude en raison de la toxicité du benzène. De même, il a été utilisé dans le passé pour dégraisser les métaux.
Dans l'une de ses utilisations classiques, il n'agit pas comme un solvant mais comme un additif: augmenter l'octane de l'essence, en remplaçant le plomb à cet effet.
Les dérivés de benzène peuvent avoir des utilisations différentes; Certains servent de pesticides, lubrifiants, détergents, plastiques, explosifs, parfums, colorants, colle, médicaments, etc. Si dans sa structure il y a un anneau benzénique, il est très probable que sa synthèse ait laissé le benzène.
Parmi ses dérivés les plus importants figurent: Cumeno, xylène, aniline, phénol (pour la synthèse des résines phénoliques), acide benzoïque (conservateur), cyclohexan (pour la synthèse du nilon), nitrobenzène, résorcinol et éthylbenzène).
Nomenclature
La nomenclature des dérivés de benzène varie en fonction du degré de substitution, quels sont les groupes substituants et leurs positions relatives. Ainsi, le benzène peut souffrir de singe, di, tri, tétra, etc., Substitutions
Lorsque les deux groupes sont liés aux carbones adjacents, la dénomination «ortho» est utilisée; S'il y a un carbone entre les séparer, «objectif»; Et si les carbones sont dans des positions opposées, «pour».
Dans les images inférieures, des exemples de dérivés de benzène avec leurs noms respectifs régis par l'IUPAC sont présentés. Ils sont également accompagnés de noms communs ou traditionnels.
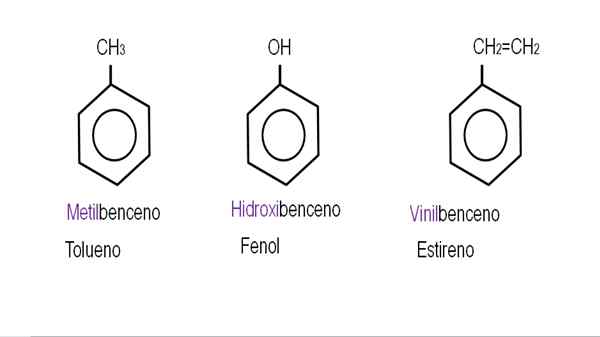 Benzène monodérivé. Source: Gabriel Bolívar.
Benzène monodérivé. Source: Gabriel Bolívar. 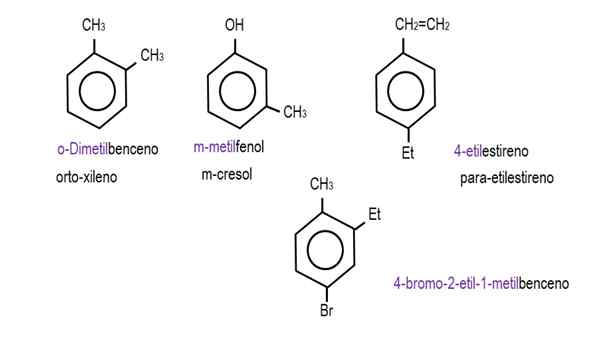 Autres dérivés de benzène. Source: Gabriel Bolívar.
Autres dérivés de benzène. Source: Gabriel Bolívar. Notez que dans le benzène trisususte, les indicateurs ortho, pour et l'objectif, ils cessent d'être utiles.
Toxicité
Le benzène est un composé qui doit être manipulé soigneusement. Compte tenu de son odeur particulière, les effets négatifs immédiats peuvent être la suffocation, les étourdissements, les maux de tête, les tremblements, la somnolence, les nausées et même la mort (avant une exposition élevée). Si, en plus de ce qui a déjà été mentionné, les douleurs à l'estomac et les convulsions peuvent provoquer une.
De plus, les effets à long terme en exposition constante à ce liquide sont cancérigènes; Augmente les chances que l'individu souffre d'un certain type de cancer, en particulier du sang: la leucémie.
Dans le sang, il peut diminuer la concentration de globules rouges, provoquant une anémie, et également affecter la moelle osseuse et le foie, où il est assimilé par le corps pour générer des dérivés de benzène encore plus toxiques; Par exemple, l'hydroxiquinone. Il s'accumule également dans les reins, le cœur, les poumons et le cerveau.
Les références
- Morrison, R.T. Et Boyd, R. N. (1987). Chimie organique. (5e édition). Addison-wesley iberoamericana.
- Carey, F. POUR. (2008). Chimie organique. (6e édition). McGraw-Hill, Intermerica, rédacteurs.POUR.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. Amines. (10e édition.). Wiley Plus.
- Centre national d'information sur la biotechnologie. (2019). Benzène. Base de données PubChem. CID = 241, récupéré de: PubChem.NCBI.NLM.NIH.Gouvernement
- Wikipédia. (2019). Benzène. Récupéré de: dans.Wikipédia.org
- Garcia Nissa. (2019). Qu'est-ce que le benzène? - Utilisation, structure et formule. Étude. Récupéré de: étudier.com
- Centres pour le Contrôle et la Prévention des catastrophes. (4 avril 2018). Faits sur le benzène. Récupéré de: urgence.CDC.Gouvernement
- Organisation Mondiale de la Santé. (2010). Exposition au benzène: un important problèmes de santé publique. [PDF]. Récupéré de: qui.int
- Fernández Germán. (s.F.). Problèmes de nomenclature de benzène. Chimie organique. Récupéré de: Chemicicaorganica.org
- « Concept de cosmopolitisme, origines, vision de Kant, société
- Géographie touristique Objet d'étude, d'origine, des sciences auxiliaires »

