Caractéristiques de support, fonctions et exemples
- 4305
- 1114
- Raphaël Meyer
Le les soutiens Ce sont les formes inactives d'enzymes, c'est-à-dire que ce sont les enzymes qui n'ont pas leurs cofacteurs ou coenzymes, qui sont essentielles pour effectuer les réactions catalytiques dont ils sont en charge.
Les enzymes sont des protéines à activité catalytique. Sa fonction accélère essentiellement le cours de différents types de réactions chimiques dans les cellules, un fait très important pour l'existence de tous les êtres vivants sur Terre.
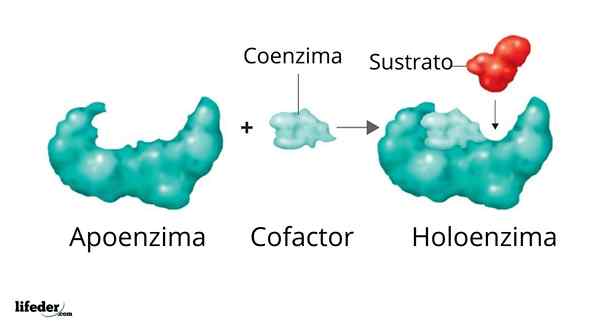
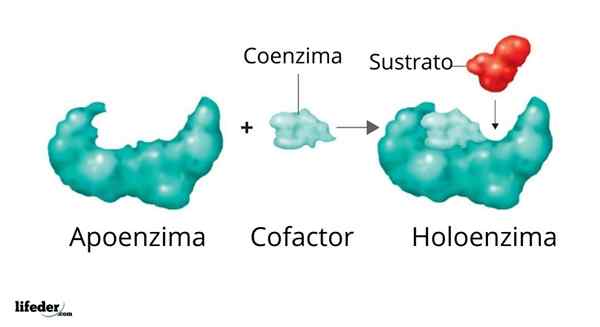 Un holoenzyme est formé par un partisan et son cofacteur / coenzyme / groupe prothétique
Un holoenzyme est formé par un partisan et son cofacteur / coenzyme / groupe prothétique L'activité de nombreuses enzymes dépend de l'identité et de l'ordre des acides aminés qui les composent, c'est-à-dire sur leurs propres structures protéiques et sur l'intégrité de ces structures dans des conditions indigène.
Bien que cela soit vrai pour de nombreuses enzymes, certains nécessitent des éléments non protéiques supplémentaires pour remplir leurs fonctions. Ces éléments sont connus sous le nom Cofacteurs, Si ce sont des ions inorganiques, ou coenzymes, Si ce sont des molécules complexes ou organiques.
Généralement, les cofacteurs et les coenzymes sont associés à une stabilité relative à la structure protéique des enzymes dont l'activité catalytique favorise; Lorsque cette association est permanente (covalente), ces groupes sont alors connus Groupes prothétiques.
Exemples de soutien
 Illustration 3D de l'ADN polymérase
Illustration 3D de l'ADN polymérase L'ensemble enzymatique actif formé par une protéine avec une activité catalytique et son cofacteur / coenzyme / prothétique est appelé Holoenzyme soit enzyme conjuguée. Dans une holoenzyme, la partie protéique correspond à ce que l'on appelle justificatif ou apoprotéine, qui manque d'activité.
Des exemples de certains supports importants sont:
- L'enzyme ADN polymérase, Responsable de la réplication de l'ADN cellulaire, sans l'ion de magnésium divalent qui sert de cofacteur.
- L'enzyme Anhydrase carbonique, en charge de catalyser la conversion de Co₂ et H₂0 en bicarbonate et ions H +, sans l'ion de zinc divalent qui sert de cofacteur.
- L'enzyme hémoglobine, en charge du transport de l'oxygène à l'intérieur des globules rouges (érythrocytes) par le sang des animaux de mammifères, sans leur groupe prothétique hemo.
- L'enzyme lactate déshydrogénase, en charge de la production de lactate de pyruvate, sans le NADH qui sert de cofacteur.
Caractéristiques des apoenzymes
Le soutien est des enzymes inactives dont ils ont besoin, afin d'atteindre leur activation, l'union d'un cofacteur ou d'une coenzyme, mais qui ne sont pas unis à un.
Compte tenu de cela, on peut dire que de telles molécules partagent certaines caractéristiques, à savoir:
Ce sont des protéines
Contrairement aux cofacteurs et aux coenzymes, qui sont des éléments non protéiques nécessaires aux fonctions des holoenzymes, le soutien est des protéines.
La déclaration précédente est donc comprise que les supports sont formés par des chaînes de molécules spéciales appelées acides aminés, qui sont liées entre elles par un type de lien connu sous le nom de liaison peptidique.
La séquence d'acides aminés de chaque soutien est génétiquement déterminée et cela, à son tour, conditionne son ordre spatial ou trois dimensions, intimement lié à la spécificité des substrats, l'union aux cofacteurs / coenzymes / groupes prothétiques, établissement du site actif, etc.
En tant que protéines, les apoenzymes ont également: une charge électrique, déterminée par leur teneur en acides aminés et le pH du milieu où ils sont trouvés; Température, pH et exigences de force ionique caractéristiques dans lesquelles il peut, en présence de cofacteurs, fonctionner à leur vitesse optimale; inhibiteurs et concurrents, etc.
Ils peuvent rejoindre des substrats
Bien qu'ils ne soient pas en mesure de catalyser une réaction enzymatique, de nombreux supports conservent la capacité de rejoindre les substrats qui participent à la réaction qui les caractérise; Pour cette raison, ils sont généralement utilisés dans certains contextes expérimentaux.
Ils peuvent rejoindre des cofacteurs, des coenzymes ou des groupes prothétiques
Dans la plupart des cas, les supports peuvent être considérés comme des enzymes inactives qui sont préparé Pour rejoindre les molécules qui assistent à leurs fonctions, c'est-à-dire: à leurs cofacteurs, coenzymes ou groupes prothétiques.
Il peut vous servir: flore et faune de la côte équatorienneLes cofacteurs peuvent participer directement aux réactions catalytiques ou simplement contribuer à la stabilisation de la structure générale de l'holoenzyme.
Parmi les principaux cofacteurs qui participent aux holoenzymes cellulaires sont:
- Fer (Fe2 +)
- Cuivre (Cu2 +)
- Calcium (Ca2 +)
- Zinc (Zn2 +)
- Magnésium (Mg2)
- Manganèse (Mn2 +)
- Cobalt (CO)
- Nickel (ni)
Parmi les principales coenzymes peut être nommée:
- Vitamines: B9, B3, C
- Adenosín triffosphate (ATP)
- Flavín adenín dinucléotide (mode)
- Nicotinamide ou nicotín dinucléotide dycleotide (NAD)
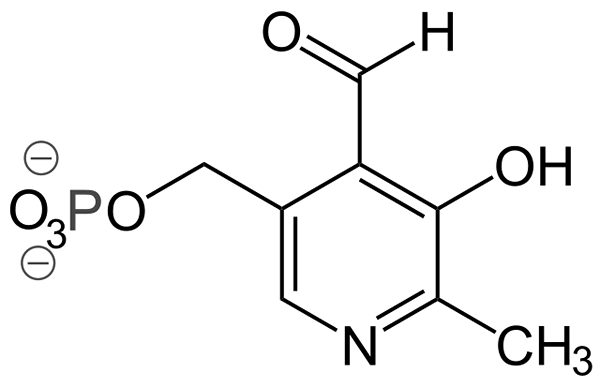 Structure piridoxal-phosphate (Source: Ayacop, domaine public, via Wikimedia Commons)
Structure piridoxal-phosphate (Source: Ayacop, domaine public, via Wikimedia Commons) Certains groupes prothétiques importants sont:
- Groupe hémo
- Biotine
- Pyrophosphate de thiamine
- Pyridoxal-phosphate
Fonctions des subenzimas
Étant donné que les supports sont les parties protéiques des holoenzymes, il est juste de les considérer comme leur partie la plus importante. Même en présence des coenzymes, des coenzymes et des substrats appropriés, sans les supports, aucune des réactions enzymatiques catalysées par ces enzymes n'a pu être effectuée.
En ce sens, la fonction principale d'un soutien est de contribuer à la fois la structure principale de l'holoenzyme à laquelle il appartient, comme site d'union pour le cofacteur, le coenzyme et / ou le groupe prothétique et les substrats qui participent à la réaction.
Du point de vue structurel, un holoenzyme sans son apoenzyme n'est rien de plus qu'un cofacteur, et un cofacteur seul n'est rien de plus qu'une molécule relativement inerte (biologiquement parlant), afin que le soutien soit en réalité pour réaliser La réaction catalytique, assistée par les éléments non protéiques mentionnés.
Peut vous servir: actinomycètesAinsi, les fonctions du support, bien que ce soit des enzymes inactives, dépendent de:
- Sa chaîne linéaire d'acides aminés ou de structure primaire (s'ils sont des complexes enzymatiques formés par plus d'une sous-unité, alors il serait discuté de «leurs chaînes linéaires»).
- La façon dont ces chaînes sont ordonnées dans l'espace, c'est-à-dire des structures secondaires, tertiaires et quaternaires, lorsque le cas.
- La conformation appropriée des sites qui sont fondamentaux pour la catalyse, c'est-à-dire le site catalytique avec les acides aminés qui participent à la réaction, le site syndical des co-enzymes, des coenzymes ou des groupes prothétiques; etc.
- La stabilité de la structure dans des conditions cellulaires ou indigène, Fait directement lié à la capacité de l'apoenzyme à former l'holoenzyme et d'autres.
Les références
- Boyer, P. D., & Krebs, et. g. (1986). Les enzymes. Presse universitaire.
- Garrett, R. H., & Grisham, C. M. (2001). Principes de la biochimie: avec un objectif humain. Brooks / Cole Publishing Company.
- Gruber, k., Puffer, B., & Kräutler, b. (2011). Vitamine B 12-dérivés-co-facteurs et ligands de protéines et d'acides nucléiques. Chemical Society Reviews, 40 (8), 4346-4363.
- Murray, R. K., Granner, D. K., Mayes, P. POUR., & Rodwell, V. W. (2014). Biochimie illustrée de Harper. McGraw-Hill.
- Nelson, D. L., Lehninger, un. L., & Cox, M. M. (2008). Principes de lehninger de la biochimie. Macmillan.
- Staiano, m., Pennacchio, un., Varriale, un., Capo, un., Majoli, un., Capacchione, c., & D'AURIA, S. (2017). Enzymes comme capteurs. Dans les méthodes en enzymologie (vol. 589, pp. 115-131). Presse universitaire.
- « Pétitionnaire pour ce qui est l'utilisation, exemple, format (modèle)
- Respiration branchiale comment il se fait et des exemples »

