Histoire de l'antimoine, structure, propriétés, utilisations et risques

- 2797
- 323
- Eva Henry
Il antimoine C'est un métalloïde argenté brillant, et avec une certaine teinte bleue. Son solide est également caractérisé par une texture squameuse très fragile et squameuse. Il appartient au groupe 15 du tableau périodique, dirigé par l'azote. Après le bismuth (et le Moscouium), c'est l'élément le plus lourd du groupe.
Il est représenté par le symbole chimique SB. Dans la nature, il se trouve principalement dans les minéraux Stabit et Ullmannite, dont les formules chimiques sont SB2S3 et nisbs, respectivement. Sa forte tendance à former des sulfures au lieu d'oxydes est parce qu'il est chimiquement doux.
 Antimoine cristallin. Source: Meilleure science.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)]
Antimoine cristallin. Source: Meilleure science.0 (https: // CreativeCommons.Org / licences / by-sa / 4.0)] D'un autre côté, l'antimoine est également physiquement doux, présentant une dureté de 3 sur l'échelle Mohs. Il est stable à température ambiante et ne réagit pas avec l'oxygène d'air. Mais lorsqu'il est chauffé en présence d'oxygène, il forme le trioxyde d'antimoine, SB2SOIT3.
Il est également résistant à l'action des acides faibles; Mais le chaud est attaqué par des acides nitriques et chlorhydrique.
L'antimoine a de nombreuses applications, parmi lesquelles sont utilisées dans les alliages avec plomb et étain, dans la fabrication de batteries pour les véhicules, les matériaux à faible frottement, etc.
Ce métalloïde a les rares possessions pour augmenter le volume lorsqu'il est solidifié, permettant à ses alliages d'occuper complètement l'espace utilisé pour modeler l'instrument souhaité pour fabriquer.
[TOC]
Historique de votre découverte
Avant Jésus-Christ
Il est prouvé que de 3100 à.C, le sulfure d'antimoine a été utilisé comme cosmétique en Égypte. En Mésopotamie, en Irak actuel, des restes d'un vase et un autre artefact ont été constatés qui auraient daté entre les 3000 et 2200 ans.C, dans lequel il a été utilisé dans son élaboration d'antimoine.
Introduction du terme
Roman Erúdito Plinio El Viejo (23-79 D.c) a décrit l'utilisation de l'antimoine, qu'il a appelé Estibio, dans l'élaboration de sept médicaments dans son traité d'histoire naturelle. L'alchimiste Abu Mussa Jahir Ibn Hayyan (721-815) est attribué à l'introduction du terme antimoine pour nommer l'élément.
Il a utilisé l'étymologie suivante: «anti» comme synonyme de déni et «mono» pour seulement. Puis il voulait souligner que l'antimoine n'était pas seul dans la nature. Il est déjà connu que cela fait partie des minéraux de soufre, qui aiment les autres éléments.
Obtention
Le naturiste grec Pedanius Diascorides est censé obtenir de l'antimoine pur, en chauffant le sulfure d'antimoine dans un flux d'air. Le Vannocio Birucicio métallurgique italien, dans le Livre de la Pyrotechnics (1540), fait une description d'une méthode pour isoler l'antimoine.
Le chimiste allemand Andreas Libavius (1615), grâce à l'utilisation d'un mélange coulé de fer, de sulfure d'antimoine, de sel et de tartrato au potassium, a atteint la production d'un antimoine cristallin.
Le premier rapport détaillé sur l'antimoine a été réalisé en 1707 par le chimiste français Nicolas Lemery (1645-1715), dans son livre traité sur l'antimoine.
Peut vous servir: chlorure de cuivre (i) (CUCL): structure, propriétés, utilisationsStructure de l'antimoine
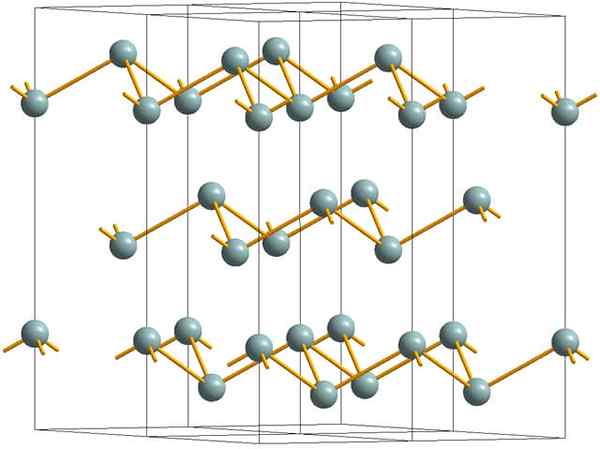 Couches ridées qui composent la structure cristalline de l'antimoine métallique ou argenté. Source: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Couches ridées qui composent la structure cristalline de l'antimoine métallique ou argenté. Source: MaterialScientist [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] L'image supérieure montre la structure des couches ridées adoptées par des atomes d'arsenic. Cependant, l'antimoine grisâtre, mieux connu sous le nom d'antimoine métallique, adopte également cette structure. On dit qu'il est "ridé" car il y a des atomes SB qui montent et tombent de l'avion composé de la couche.
Ces couches, bien qu'ils soient responsables des photons qui interagissent avec lui pour briller des paillettes en argent, faisant de l'antimoine comme un métal, la vérité est que les forces qui les unissent sont faibles; D'ici aux fragments de métal apparentes de SB peut facilement être montré et sont cassants ou des baskets.
De plus, les atomes SB dans les couches ridés ne sont pas suffisants pour regrouper leurs orbitales atomiques et créer ainsi une bande qui permet une conduction électrique.
Voyant une sphère grisâtre individuellement, vous pouvez voir qu'il a trois liens SB-SB. À partir d'un avion supérieur, le SB pouvait être vu au centre d'un triangle, avec trois SB situés à ses sommets. Cependant, le triangle n'est pas plat et a deux niveaux ou planchers.
La reproduction latérale de ces triangles et de leurs liens établit des couches ridées, qui sont alignées pour former des cristaux rhomboébiques.
Allotropie
La structure nouvellement décrite correspond à l'antimoine grisâtre, le plus stable de ses quatre alotropes. Les trois autres alotropes (noir, jaune et explosif) sont métastables; c'est-à-dire qu'ils peuvent exister dans des conditions très rigoureuses.
Il n'y a pas trop d'informations sur ses structures. Il est connu, cependant, que l'antimoine noir est amorphe, de sorte que sa structure est désordonnée et complexe.
L'antimoine jaune est stable en dessous de -90 ° C, il se comporte comme un élément non métallique, et peut être conjecturé qui se compose de petits agglomérats de SB4 (similaire au phosphore); Lorsqu'il est chauffé, il se transforme en alotrope noir.
Et en ce qui concerne l'antimoine explosif, il se compose d'un réservoir gélatineux formé sur la cathode pendant l'électrolyse d'une solution aqueuse d'un halogénure d'antimoine.
Au moindre Rubb fort.
Propriétés
Poids atomique
121,76 g / mol.
Numéro atomique
51.
Configuration électronique
[Kr] 4ddix5s25 P3.
États d'oxydation
-3, -2, -1, +1, +2, +3, +4, +5.
Description physique
Argent brillant, surface fragile et squameuse, avec une teinte bleue. Il peut également apparaître comme une poussière noire.
Point de fusion
630,63 ºC.
Point d'ébullition
1.635 ºC.
Densité
-6 697 g / cm3 à température ambiante.
-6,53 g / cm3 À l'état liquide, température égale ou supérieure au point de fusion.
Chaleur de fusion
19,79 kJ / mol.
Chaleur de vaporisation
193.43 kJ / mol.
Peut vous servir: sulfure de cuivre: structure, propriétés, utilisationsCapacité calorique molaire
25.23 J / mol.K
Électronégativité
2.05 (échelle Pauling).
Radio atomique
140 h.
Dureté
C'est un élément doux, avec une dureté de 3 sur l'échelle Mohs et peut être rayé par le verre.
La stabilité
Il est stable à température ambiante, ne subissant pas d'oxydation. Il est également résistant aux attaques acides.
Isotopes
Il a deux isotopes stables: 121SB et 123Sb. De plus, il y a 35 isotopes radioactifs. L'isotope radioactif 125SB est celui qui a la plus grande demi-vie: 2,75 ans. En général, les isotopes radioactifs émettent le rayonnement β+ et β-.
Conductivité électrique et thermique
L'antimoine est un mauvais conducteur de chaleur et d'électricité.
Réactivité chimique
Ne peut pas déplacer l'hydrogène des acides dilués. Forme complexe ionique avec des acides organiques et inorganiques. L'antimoine métallique ne réagit pas avec l'air, mais il est rapidement converti en oxyde dans l'air humide.
Les halogènes et les sulfures oxydent facilement l'antimoine, si le processus se produit à des températures élevées.
Applications
Alliages
L'antimoine est utilisé en alliage avec du plomb pour l'élaboration des plaques pour les batteries de la voiture, améliorant la résistance des plaques, ainsi que les caractéristiques des charges.
L'alliage en plomb et en étain a été utilisé pour améliorer les caractéristiques des soudures, ainsi que celle des balles et cartouches de traceur. Il est également utilisé dans les alliages pour le revêtement de câbles électriques.
L'antimoine est utilisé dans les alliages d'antifriction, dans la préparation d'alliages de pelage et de durcissement avec une faible teneur en étain dans la fabrication d'organes et d'autres instruments de musique.
Il présente la caractéristique, partagée avec l'eau, d'augmenter le volume lorsqu'elle est condensée; Ainsi, l'antimoine présent dans les alliages avec plomb et étain, remplit tous les espaces des moules, améliorant la définition des structures faites avec ces alliages.
Retardateur de flamme
Le trioxyde d'antimoine est utilisé pour l'élaboration des composés d'allumage, toujours en combinaison avec des retardateurs de feu halogénés, des bromuros et du chlorure.
Les retardateurs d'incendie peuvent réagir avec l'oxygène et les atomes radicaux oh, ce qui inhibe le feu. Ces allumeurs sont utilisés dans les vêtements pour les enfants, les jouets, les avions et les sièges d'auto.
Ils sont également ajoutés dans les résines en polyester et dans des compositions en fibre de verre pour les articles utilisés tels que les moteurs d'aéronef légers.
Les composés d'antimoine qui sont utilisés comme retardateurs d'incendie comprennent: l'oxychlorure d'antimoine, SBOCL; Pentoxyde d'antimoine, SBO5; Trichlorure d'antimoine, SBCL3; et trioxyde d'antimoine, SBO3.
Champ électronique
Il est utilisé dans la fabrication de semi-conducteurs, de diodes, de détecteurs infrarouges moyens et dans l'élaboration des transiteurs. L'antimoine de haute pureté, utilisé dans la technologie des semi-conducteurs, est obtenu par la réduction des composés d'antimoine avec de l'hydrogène.
Peut vous servir: facteurs qui affectent la solubilitéMédicament et vétérinaire
Les composés d'antimoine sont utilisés en médecine depuis les temps anciens tels que les éméticas et les antiprotozoaires. Le tartrato potassium de potassium (tartre esthétique) a été utilisé comme antisquisosomal pendant longtemps; Également utilisé comme expectorant, diaphorétique et émético.
Les sels d'antimoine ont également été utilisés dans le conditionnement de la peau des animaux ruminants; comme l'aniomaline, le lithium et l'antimoine tiomalate.
L'antimoine Meglumine est un médicament utilisé dans le traitement de la leishmaniose sous les projecteurs externes des animaux domestiques. Bien que les avantages thérapeutiques soient rares.
Pigments et peintures
Les composés de l'antimoine sont utilisés dans l'élaboration des peintures et de l'opacificateur dans les émaux. Ils sont également utilisés dans les pigments Bermellón, jaunes et orange, qui sont des produits de l'oxydation lente des sulfures d'antimoine.
Certains de ses sels biologiques (tartrat) sont utilisés dans l'industrie textile pour aider dans le lien de certains colorants.
Le sulfure d'antimoine a été utilisé dans l'Égypte ancienne comme cosmétique dans l'assombrissement des yeux.
Autres utilisations
Certains sels d'antimoine sont utilisés comme agents de revêtement pour éliminer les bulles microscopiques formées sur les écrans de télévision. Les ions antimoine interagissent avec l'oxygène, éliminant leur tendance à former des bulles.
Le sulfure d'antimoine (III) est utilisé dans les têtes de certains matchs de sécurité. Le sulfure d'antimoine est également utilisé dans la stabilisation du coefficient de frottement des matériaux utilisés dans les plaquettes de frein de voiture.
L'isotope 124SB, avec le béryllium, est utilisé comme source de neutrons, avec une moyenne énergétique de 24 kev. De plus, l'antimoine est utilisé comme catalyseur dans la production de plastiques.
Des risques
C'est un élément cassant, de sorte qu'une poudre de polluants de l'environnement peut se produire pendant la manipulation. Chez les travailleurs exposés à la poussière d'antimoine, à la dermatite, à la rénoïté, à une inflammation des voies respiratoires élevées et de la conjonctivite a été observée.
Une pneumoconiose a été décrite, parfois combinée à des changements pulmonaires obstructifs, après des expositions prolongées.
Le trioxyde d'antimoine peut endommager le fonctionnement cardiaque qui peut être mortel.
Chez les personnes exposées à cet élément, la présence d'infections cutanées pustules a été observée, de nature transitoire.
L'apport continu à faible dose de ce métal peut provoquer des vomissements de diarrhée et des ulcères d'estomac. De plus, la concentration maximale tolérable dans l'air est de 0,5 mg / m3.
Les références
- Fhiver & Atkins. (2008). Chimie inorganique. (Quatrième édition). Mc Graw Hill.
- Manche. (11 mars 2009). Antimoine jaune et antimoine explosif. Récupéré de: AntimonyProperties.Blogspot.com
- Prof. Ernst Cohen et J. C. Van den Bosch. (1914). L'allotropie de l'antimoine. Procédures Royal Acad. Amsterdam. Vol. Xvii.
- Wikipédia. (2019). Antimoine. Récupéré de: dans.Wikipédia.org
- Advameg, Inc. (2019). Antimoine. Récupéré de: chimie-explayée.com
- Sabre Mc'oneal. (15 septembre 2018). Chimie: propriétés et application de l'antimmonie SB. Récupéré de: moyen.com
- « Histoire de la biogéographie, quelles études et exemples de recherche
- Causes de pollution auditive, conséquences, solutions »

