Formation anion, caractéristiques et types
- 1495
- 115
- Raphaël Meyer
UN anion Ce sont toutes des espèces chimiques avec une charge négative, en plus d'être l'un des deux types d'ions existants. Sa charge négative provient du fait qu'elle présente un excès d'électrons par rapport à la forme neutre de l'espèce; Pour chaque électron supplémentaire, sa charge négative augmente dans une unité.
La charge négative peut être située dans un ou plusieurs atomes, ainsi que couvrant son influence sur une molécule dans son intégralité. À titre de simplification, quel que soit la charge (-), elle est considérée comme un anion pour toute l'espèce, le composé ou la molécule.
 Anions. Source: Gabriel Bolívar.
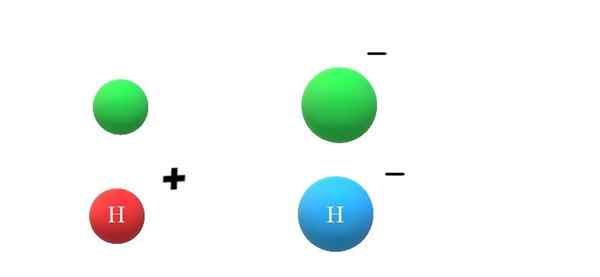
Anions. Source: Gabriel Bolívar. Si une espèce neutre gagne un électron, des charges négatives excessives se manifesteront dans la formation de l'anion x-, qui portera également l'augmentation de son rayon atomique (image supérieure, avec des sphères vertes). X et x- Ils diffèrent considérablement de leurs propriétés et de la façon dont ils interagissent avec leur environnement.
Si c'est maintenant censé+ ou h-, respectivement. Le cation h+ C'est l'ion hydrogène, également appelé proton; et h- C'est l'anion hydrure, le plus "simple" de tous les anions connus.
[TOC]
Formation d'un anion
La formation d'un anion peut être facilement expliquée dans la théorie; Bien que, expérimentalement, cela peut devenir un défi, surtout si vous voulez pur, sans charges positives attirées par vos charges négatives.
Charges formelles et moins de liens
Un anion sera formé lorsqu'il y aura un excès ou un gain d'électrons dans un atome. Ce gain peut être déterminé en utilisant des charges formelles dans une structure Lewis. De plus, grâce à la méthode précédente, vous pouvez savoir exactement quel atome ou un groupe d'entre eux vient la charge négative.
Peut vous servir: acétonitrile (C2H3N)Lorsque les atomes forment des liaisons covalentes, bien que la distribution des électrons soit équitable, il peut y avoir une perte partielle d'électrons. En ce sens, moins les liens forment les paires les plus électronégatives et les plus sans électrons qu'ils auront et afficheront donc des charges négatives.
Considérez par exemple la molécule d'ammoniac, NH3. Le NH3 Il est neutre et n'a donc pas de charges électriques. Si un H était supprimé, c'est-à-dire un lien N-H a été rompu, l'anion NH serait obtenu2-. Dessiner sa structure Lewis et calculer la charge formelle du n vous pouvez vérifier ce.
Après la rupture de plus de liens N-H, vous avez maintenant l'anion NH2-; et éliminant le dernier h, l'anion n est enfin obtenu3-, appelé anion nitruro. L'azote n'a plus comment gagner plus d'électrons, et sa charge -3 est la plus négative qu'elle peut atteindre; Ses orbitales ne donnent pas plus.
Réductions
Un anion peut former un produit d'une réduction: gagne des électrons s'oxydant à une autre espèce, qui les perd. L'oxygène, par exemple, représente très bien ce type de réaction chimique.
Lorsque l'oxygène est réduit, oxydé à une autre espèce et devient anion oxyde, ou2-; présent dans d'innombrables minéraux et des composés inorganiques.
Physique
Un atome peut gagner des électrons s'il est en phase gazeuse:
X (g) + e- => X-(g)
Cette façon de former un anion implique une large connaissance des techniques physiques, tandis que les anions gazeux ne sont pas faciles à étudier, et toutes les espèces ne sont pas volatisées ou atomisées avec simplicité à la phase gazeuse.
Caractéristiques
En termes généraux, les caractéristiques typiques d'un anion seront mentionnées ci-dessous avant de traiter ses types et exemples:
-Est plus encombrant que l'atome neutre à partir de laquelle.
Peut vous servir: dioxyde de chlore (CLO2): structure, utilisations, objets, risques, propriétés-Il peut être plus ou moins stable, malgré la répulsion électronique croissante parmi ses propres électrons.
-Si l'anion vient d'un peu d'atome électronégatif, comme le carbone, il est très réactif.
-Définir de forts moments dipolaires.
-Augmente encore son interaction avec les solvants polaires.
-L'anion monoatomique est isoléctronique du gaz noble de sa période; c'est-à-dire qu'il a dans sa couche de valence le même nombre d'électrons.
-Il peut polariser le nuage électronique d'un atome voisin, en répétant ses électrons externes.
Gars
Monoatomique
Comme son nom l'indique, c'est un anion qui se compose d'un seul atome: la charge négative est bien située. Chaque groupe du tableau périodique a des charges négatives caractéristiques; Et parce que ce sont des anions, ce sont les non-métaux situés dans le bloc P. Quelques exemples et leurs noms sont ci-dessous:
-CL-, chlorure.
-Toi-, Je dure.
-F-, fluorure.
-BR-, bromure.
-SOIT2-, oxyde.
-S2-, sulfure.
-IL2-, Séléniuro.
-Thé2-, Telururo.
-Pote2-, polyoniuro.
-N3-, Nitruro.
-P3-, phosphouro.
-As3-, arseniuro.
-Sb3-, Antimoniuro.
-C4-, carbure.
-Ouais4-, Siliciuro.
-B3-, Boruro.
Oxoanions
Les oxoanions sont caractérisés par une liaison x = o, où x peut être n'importe quel élément non métallique (sauf le fluorure), ou un métal (chrome, manganèse, ect.). Ils peuvent également avoir un ou plusieurs liens X-O simples.
Certains oxoanions avec leurs noms respectifs sont:
-CLO-, hypochlorite.
-Copain-, Hipobromito.
-Io-, hypoyodite.
-CLO2-, Chlorite.
-CLO3-, chlorate.
-Io3-, Yodato.
-CLO4-, se perchorer.
-Pote43-, phosphate.
-CO32-, carbonate.
-Cro42-, chromate.
-Croisement2SOIT72-, Dicromato.
-Swin42-, sulfate.
-S2SOIT32-, Tiosulfate.
-NON3-, nitrate.
-NON2-, nitrite.
-Bêle33-, borate.
-ASO43-, arseniato.
-Pote33-, phosphite.
-Mne4-, permanganate.
BIO
Les molécules organiques ont des groupes fonctionnels qui peuvent être chargés électriquement. Comme? Par formation ou rupture des liaisons covalentes, très similaire à l'exemple de la molécule NH3.
Peut vous servir: fer (élément): caractéristiques, structure chimique, utilisationsCertains anions organiques sont:
-Ch3Roucouler-, acétate.
-Hcoo-, Format.
-C2SOIT42-, Oxalate.
-Rcoo-, Carboxylate.
-Ch3Conh-, Amidato.
-Ro-, Alcoxyde.
-R3C-, Carbanion.
-Ch3SOIT-, Métoxyde.
Polyiatomique
Les oxoanions sont également des anions poliatomiques, c'est-à-dire qu'ils se composent de plus d'un atome. Il en va de même pour les anions organiques. Cependant, les polyiatomiques n'entrent aucune des classifications précédentes. Certains d'entre eux sont:
-CN-, cyanure (a un triple lien, C≡N).
-OCN-, Cyanate.
-SCN-, Tiocianato.
-NH2-, Amiduro.
-Oh-, hydroxyle, hydroxyde ou oxydrillo.
-SOIT2-, superoxyde.
-SOIT22-, peroxyde.
Moléculaire ou complexe
Dans les anions organiques, certains groupes fonctionnels chargés négativement ont été mentionnés. Ces groupes peuvent faire partie d'une grande molécule, et donc l'anion peut être un composé robuste et de nombreux liens. La plus simple de ce type d'anions est la molécule H hypothétique2-.
Parmi un autre exemple de ces anions, les polysulfuros, sn2-, qui se composent de chaînes avec plusieurs liens S-S. De même, les composés de coordination des métaux avec charge négative peuvent être comptés, comme [COCL4(NH3)2]]- et [CUCL4]]2-.
Les références
- Whitten, Davis, Peck & Stanley. (2008). Chimie. (8e Ed.). Cengage Learning.
- Wikipédia. (2019). Anion. Récupéré de: est.Wikipédia.org
- Helmestine, Anne Marie, Ph.D. (21 mars 2019). Table des anions et liste de formules communes. Récupéré de: Thoughtco.com
- Fondation CK-12. (29 juin 2016). Formation d'anions. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- Francis E. (2002). Anions. Collège communautaire de Clackamas. Récupéré de: DL.clackamas.Édu
- American Physical Society. (3 novembre 2011). Synopsis: l'anion moléculaire le plus simple. Récupéré de: physique.SPA.org
- « Fernando del Paso Biographie, style, œuvres et phrases
- Structure Anisol, propriétés, nomenclature, risques et utilisations »

