Amidas
- 4408
- 950
- Mlle Ambre Dumont
Nous expliquons ce que les amides, leurs caractéristiques, leur structure, leurs types, leur nomenclature et nous donnons plusieurs exemples sont
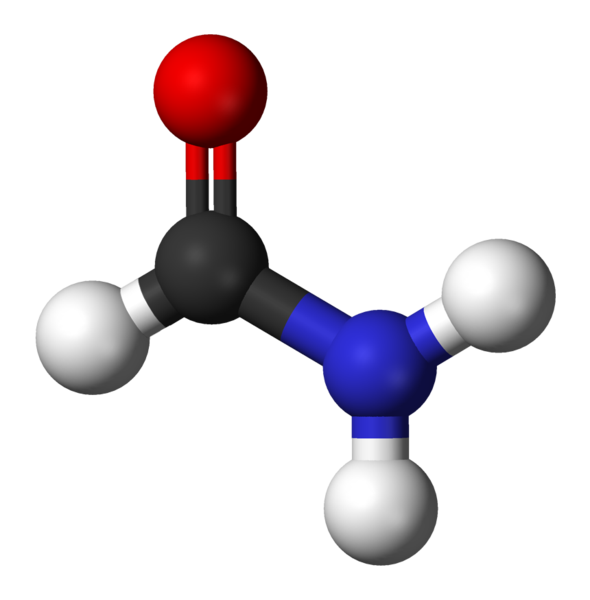
 Formamide, l'amida le plus simple
Formamide, l'amida le plus simple Que sont les amidas?
Les amidas sont un type de composés organiques formés par l'union entre un acide carboxylique et une amine. Ils sont également appelés amines acides et à partir de là, c'est précisément d'où vient le mot amide.
Ces composés sont très importants pour la vie, car ils sont une partie essentielle des protéines, des peptides et des hormones. Ils font également partie des bases azotées de l'ADN et de l'ARN, qui contiennent nos informations génétiques.
Les amidas sont également très importants dans l'industrie. Par exemple, Le nylon C'est l'une des fibres synthétiques les plus utilisées dans le monde et est formée par une longue chaîne d'amides unis les uns après l'autre.
De plus, les amides sont beaucoup utilisés dans l'industrie pharmaceutique, car ils font partie de médicaments tels que la lidocaïne.
Caractéristiques des amides
- Presque tous sont solides: Tous les amides sont solides à température ambiante, sauf le plus petit et le plus simple qui soit le formamide. Ce dernier est liquide.
- Ils ont un point d'ébullition élevé: Par rapport aux acides carboxyliques et aux amines dont ils sont fabriqués, les amides ont un point d'ébullition élevé. Par exemple, l'acétamide (choisissez3Conh2) Il est formé par l'union de l'acide acétique (vinaigre) avec de l'ammoniac. Le point d'ébullition de l'acétamide est de 221,2 ºC, tandis que celui de l'acide acétique est de 118 ºC et l'ammoniac est de -33,34 ºC.
- Certains sont solubles dans l'eau: Les plus petits amides se mélangent bien avec l'eau, il est donc facile de les dissoudre dedans. Cependant, à mesure qu'ils deviennent plus gros, ils deviennent moins solubles.
- Ils sont moins basiques que les amines: Un amida est toujours moins basique (ou plus acide) que l'amine à partir de laquelle il vient. En fait, le nom d'Amida vient de combiner à moiNa + acidonner.
- Votre lien est facilement cassé: Si une base forte en catalyseur est ajoutée, les amides réagissent rapidement avec l'eau. Cette réaction est appelée hydrolyse et pendant la même chose, l'amida est brisée pour former l'acide d'origine et l'amine.
- Ils sont incolores et les toilettes: En général, les amides sont des substances qui n'ont pas de couleur ou d'odeur caractéristique.
Structure de groupe fonctionnel
Chimiquement, l'amida est un groupe fonctionnel qui contient un groupe carbonyle (c = o) d'un acide carboxylique, lié à l'azote d'ammoniac ou d'amine. La structure générale des amides est:
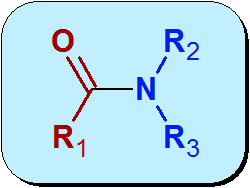 La partie rouge de la molécule dans l'image précédente provient de l'acide carboxylique et est appelée Acyle. La partie bleue vient de l'amida.
La partie rouge de la molécule dans l'image précédente provient de l'acide carboxylique et est appelée Acyle. La partie bleue vient de l'amida.
Une caractéristique de la structure des amides qui les distingue des amines est que la paire d'électrons libres qui le possède avec le groupe carbonyle à travers un processus appelé Resonance. C'est ce qui rend les amies moins basiques que les amines.
Types d'amides
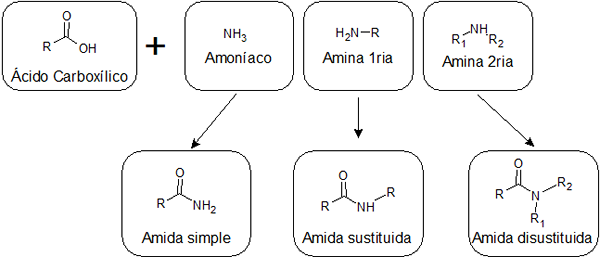
Selon que l'acide est combiné avec l'ammoniac, avec un amina primaire ou avec une amine secondaire, trois types d'amides avec différentes structures peuvent être obtenus:
Amides simples
Ils sont formés par l'union entre un acide carboxylique et l'ammoniac. Ce type d'amida a un groupe -nh2 Lié au groupe carbonyle. Les amides simples peuvent former plusieurs liaisons hydrogène les unes aux autres et avec de l'eau, de sorte qu'elles sont généralement plus solubles que celles remplacées.
- Exemples d'Amida simples: formamide, acétamide et butyramide.
Amides remplacés
Ils sont obtenus par l'union d'un acide et d'une amine primaire. Dans ce cas, l'un des hydrogènes de -nh2 Des amides simples sont remplacés par un alkyle, et c'est pourquoi on leur dit remplacé.
- Exemple d'un amide remplacé: Le lien entre les acides aminés dans les protéines.
Amides dispersés
Ils proviennent de la réaction entre un acide et une amine secondaire. Dans ce cas, les deux hydrogènes du groupe -nh2 Ils sont remplacés par des groupes alkyle. Les amides désaccords n'ont pas d'hydrogène attaché aux nitrogènes, ils ne peuvent donc pas former des ponts d'hydrogène les uns avec les autres, et un seul faible avec de l'eau. Cela les rend moins solubles dans l'eau que les autres types d'amides.
Lactamas, primaire, secondaire et tertiaire amidas
En dehors des trois types d'amides nouvellement mentionnés, il y a aussi Amides primaires, secondaires et tertiaires, qui diffèrent en ayant un, deux ou trois groupes acides unis à l'atome d'azote.
Enfin, certains amides forment des cycles fermés. Dans ce cas, le composé est appelé lactame. Les lactamas sont de nature très importante. Par exemple, l'uracile qui fait partie de l'ARN, est un lactame.
Nomenclature of Amidas
Amides simples
Les amides simples sont nommés du nom de la chaîne de carbone de l'acide dont ils proviennent (la chaîne principale). Le nom est construit en plaçant le préfixe indiquant le nombre de carbones (méthan-, butan-, hexan-, etc.) ou le nom commun de l'acide en supprimant la terminaison -oico ou -ico (comme dans ApétICO) Et ajouter la terminaison -amida.
- Exemple: l'amide qui vient de l'acide acétique, est appelé acétamide et celui qui provient de l'acide propanóique est appelé propanamide.
Amides remplacés et désagréables
Dans ce cas, il commence par nommer les groupes alkyles unis à l'azote, précédés de la lettre n-. Alors le reste de l'amida est nommé la chaîne principale.
Il peut vous servir: Soufre: Historique, propriétés, structure, obtention, utilisationsExemple:
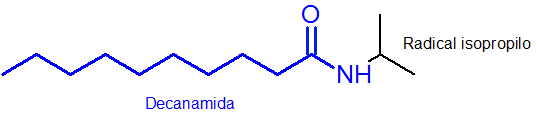 Comme on peut le voir, le substituant attaché à l'azote est un groupe isopropylique, il est donc inclus dans le nom en tant que N-Osopropyl (le dernier «O» est toujours retiré au nom du radical).
Comme on peut le voir, le substituant attaché à l'azote est un groupe isopropylique, il est donc inclus dans le nom en tant que N-Osopropyl (le dernier «O» est toujours retiré au nom du radical).
Le reste de la chaîne principale, qui a le groupe fonctionnel Amida, a 10 atomes de carbone. C'est-à-dire que votre nom doit avoir le préfixe décanté - suivi de la terminaison Amida, ou ducanamide. Alors lui Le nom complet est N-OsopropildEcanamide.
Exemples d'amides
- Benzamide c6H5Conh2
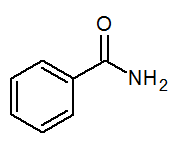
- N, n-diméthylacétamide ch3Avec (ch3)2
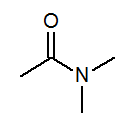
- Acétamide ch3Conh2
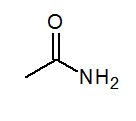
- Phénylacétamide (c6H5) Ch2Conh2
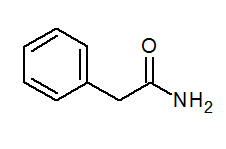
- N-Butil-n-propilformamide HCon (C3H7) (C4H9)
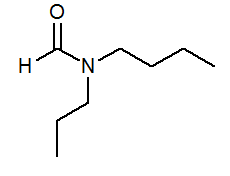
- 4-hydroxybanamide ch2(Oh) Cho2Ch2Conh2
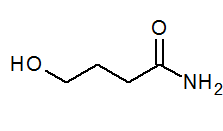
- Urea Co (NH2)2
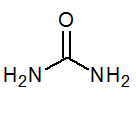
- Propanamide ch3Ch2Conh3
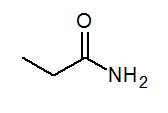
- N-butil-2-echopilpetanamida ch3Ch2Ch2Ch (c3H7) Conh (c4H9)

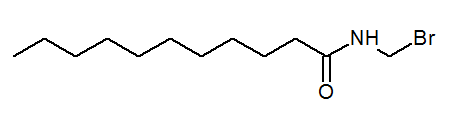
- N- (bromométhyl) uncanamide cho3(Ch2)9Conhch2BR
Les références
- Britannica, t. Éditeurs d'Encyclopaedia (2019, 15 mai). Amide. Encyclopédie Britannica. Pris de Britannica.com
- Amis- structures et noms. (2020, 17 août). Tiré de Chem.Bibliothèque.org
- Carey, F. POUR. (2008). Chimie organique. Boston: McGraw-Hill Higher Education.
- Smith, M., March, J., & March, J. (2001). La chimie organique avancée de mars: réactions, mécanismes et étendus. New York: Wiley.
- Zabicky, J. (1970). La chimie des Amis, partie 1. New York: Wiley

