Caractéristiques de l'alizarine, préparation, utilisations et toxicité
- 1770
- 75
- Justine Charpentier
La alizarine Il s'agit d'un ensemble de colorants organiques qui sont obtenus naturellement à partir des racines d'une plante blonde, découverte par le chimiste français Pierre-Jean en 1826.
La première teinture synthétisée était le rouge d'Alizarina, mais il y a aussi le jaune d'alizarine, le bleu d'alizarine et le violet Alizarin. De tous ceux mentionnés, le rouge d'Alizarina est celui qui a les plus grandes applications, et pour être le plus utilisé normalement, nous nous appelons simplement Alizarina.
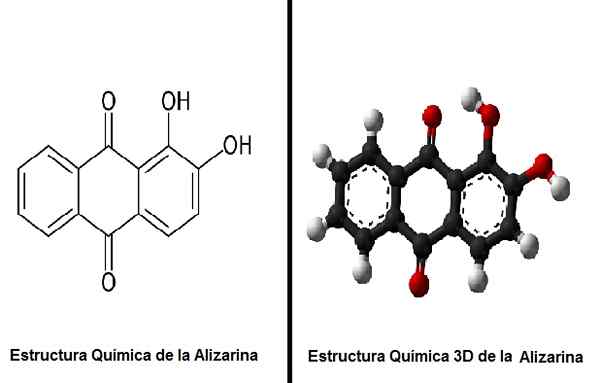
 Structure chimique de l'alizarine et de la structure 3D de l'alizarine. Source: Arrowsmaster [Domaine public] / Ben Mills et Jynto [Domaine public]
Structure chimique de l'alizarine et de la structure 3D de l'alizarine. Source: Arrowsmaster [Domaine public] / Ben Mills et Jynto [Domaine public]
Le rouge d'Alizarina a été le premier à synthétiser artificiellement (synthétique) d'Anthracène, grâce à la découverte de deux chimistes allemands, Carl Graebe et Carl Liebermann, en 1868. Le nom scientifique du rouge d'Alizarina est 1,2dihydroxiantraquinona, et sa formule chimique est C14H8O4.
L'utilisation d'un pigment de racine blonde pour teindre les tissus date de l'époque du pharaon Tutankhamun, comme en témoignent les résultats trouvés dans sa tombe. De même, il a également été observé dans les ruines de Pompeya.
Par la suite, au moment de Charlemagne, la culture de la blonde a été encouragée, devenant un exercice économique important de la région.
Pendant longtemps, il a été utilisé pour teindre les tissus qui ont fait les uniformes des soldats appartenant à l'armée anglaise et aux Britanniques. Les uniformes avaient une couleur rouge très particulière qui les caractérisait; Être appelé par des scories populaires vestes rouges.
[TOC]
Caractéristiques
Alizarina était un composé essentiel dans la fabrication de différentes teintures ou pigments, de la blonde, généralement appelée "Rose Madder" et "Carmín de Alizarina". De ces teintures, le nom de Red Crimson est sorti.
Aujourd'hui, le rouge Alizarina est utilisé comme colorant pour la détermination de diverses études qui impliquent le calcium. C'est une poudre formée par de petits cristaux rouge-orage ou une puissance orange. Il est également connu sous le nom d'Alizarina Red. Sa masse moléculaire est de 240,21 g / mol, et son point de fusion est de 277-278 ° C.
Peut vous servir: sélection perturbatrice: qu'est-ce que la définition, des exemplesLa forme naturelle est obtenue à partir des racines de la blonde, spécifiquement à partir des espèces r. tinctorum et r. Cordifolia.
Par la suite, la production de pigments naturels de la racine de la blonde a été remplacée par la production synthétique à partir de l'anthracène. Ce processus nécessite l'oxydation de l'acide antraquinone-2-sulfonique avec du nitrate de sodium dans une solution concentrée d'hydroxyde de sodium (NaOH).
Après le 1958, l'utilisation de l'alizarine rouge a été remplacée par celle des autres pigments par une plus grande stabilité de la lumière. Des exemples sont ceux dérivés de la quinacridone développé par dupont.
Variantes d'alizarine (colorants alizariniques)
Toutes les variantes ont un noyau antraquinonique en commun.
Alizarina Carmine
Le carmin d'alizarine est dérivé du précipité d'alizarine, un pigment de laquer qui donne une bonne permanence sur les substrats et est semi-rouge.
Alizarin jaune
Il existe une variante appelée alizarine jaune utilisée comme indicateur de pH. Cette substance en dessous de 10,2 est jaune, mais au-dessus de 12 est rouge.
Alizarina Blue
Pour sa part, Alizarina Blue est un indicateur de pH qui a deux zones de virage: un pH entre 0.0-1.6, où il passe du rose au jaune, et un autre tour de virage entre pH 6,0-7.6, dont le changement est jaune en vert.
Alizarina Violet
Il s'agit d'un colorant utilisé pour la détermination spectrophotométrique de l'aluminium en présence de substances tenseactive.
Préparation de la solution rouge Alizarina
La préparation dépendra de l'utilité à donner. Par exemple, dans les techniques d'évaluation des processus de biominéralisation, il est utilisé à une concentration de 0,1%
Il peut vous servir: oxydorreductases: caractéristiques, structure, fonctions, exemplesPour le marquage des algues corail géniculées, la concentration avec le meilleur résultat est de 0,25%.
Applications
S'il est vrai que pendant des années, Alizarin a été utilisé comme teinture pour les textiles, il a aujourd'hui d'autres applications. Par exemple, au niveau de la santé, il est utile de déterminer la présence de calcium de diverses manières.
Dans d'autres domaines tels que la géologie, l'alizarine est utile pour détecter certains minéraux, tels que le carbonate de calcium, l'aragonite et la calcite.
Utilisations les plus fréquentes
Il est actuellement largement utilisé pour révéler la présence de dépôts de calcium dans la formation de tissu osseux. L'un des domaines qui utilise la plupart des alizarines est l'histochimie.
Par exemple, il est utilisé pendant le processus de biominéralisation dans les cultures cellulaires in vitro de la ligne ostéogénique, où les taches de calcium d'alizarine rouge se sont formées pendant le processus.
Également dans la technique de la diafanisation, une procédure qui permet d'étudier le développement des os et dentaires chez les animaux d'expérimentation. Grâce à Red Alizarin, les centres d'ossification sont identifiés.
D'un autre côté, il est utile de détecter la présence de cristaux de phosphate de calcium dans le liquide synovial.
Enquêtes qui ont utilisé le colorant alizarine
Vanegas et collaborateurs ont utilisé l'alizarine rouge pour évaluer le développement d'ostéoblastes sur les surfaces en titane; Matériel candidat pour la fabrication d'implants dentaires. Grâce à cette technique de coloration, il pouvait observer que les ostéoblastes ont réussi à adhérer, à proliférer et à biominéraliser sur les surfaces éprouvées.
D'un autre côté, Rivera et les collaborateurs ont évalué le taux d'âge et de croissance des algues corail dans le sud-ouest du golfe de Californie, au Mexique,. Les auteurs ont fait deux types de marquage. Le premier était l'utilisation d'Alizarina Red et la seconde avec des marques de fil en acier inoxydable métalliques. Le marquage d'Alizarina était la meilleure technique à cet effet.
Il peut vous servir: Agar TCBS: Qu'est-ce que la fondation, la préparation, l'utilisationDe même, Aguilar P a étudié la validation de la méthode potentiométrique d'ion sélectif en utilisant l'alizarine pour la détermination du fluor dans le sel, l'eau et l'urine, ce qui a entraîné une méthode satisfaisante.
Les dantas et les collaborateurs ont utilisé le violet d'Alizarin N (AVN) comme réactif spectrophotométrique dans la détermination de l'aluminium, obtenant de bons résultats.
Toxicité
La NFPA (National Fire Protection Association) classe Alizarin Red comme suit:
- Risque pour la santé en grade 2 (risque modéré).
- Risque de l'inflammabilité en grade 1 (risque léger).
- Risque de réactivité à grade 0 (il n'y a aucun risque).
Les références
- Vanegas J, Garzón-Alvarado D, Casale M. Interaction entre les ostéoblastes et les surfaces en titane: application dans les implants dentaires. Rev Cuban Invest Bioméd. 2010; 29 (1). Disponible sur: SCIELO.org
- Rivera G, García A, Moreno F. Technique de diafanisation Alizarin pour l'étude du développement osseux Colombian Magazine Free Health. 2015; 10 (2): 109-15. Disponible sur: ResearchGate.
- Aguilar P. Validation de la méthode potentiométrique par ion sélectif pour la détermination du fluorure dans le sel, l'eau et l'urine. Pérou. Médicament. Exp. santé publique. 2001; 18 (1-2): 21-23. Disponible sur: SCIELO.org.PE / SCIELO
- "Carmín de Alizarina.”Wikipedia, encyclopédie gratuite. 8 mai 2017, 15:54 UTC. 30 mai 00:19.
- "Alizarine.”Wikipedia, encyclopédie gratuite. 20 février 2019, 15:52 UTC. 30 mai 00:21 est.Wikipédia.org.
- Dantas, Alailson Falcão, Costa, Antônio CelSo Spínola et Ferreira, Sérgio Luís Costa. Utilisation de Violeta de Alizarin N (AVN) comme réactif spectrophotométrique NA Aluminium Détermination. Chemistry Nova, 2000; 23 (2), 155-160. Disponible sur: SCIELO.org
- « L'histoire et le sens du drapeau de Lituanie
- Structure de l'acétate d'ammonium, propriétés, utilisations et risques »

