Structure de l'acétate d'ammonium, propriétés, utilisations et risques

- 4722
- 678
- Justine Charpentier
Il Acétate d'ammonium C'est un sel inorganique dont la formule chimique est NH4Ch3COOH. Il dérive du mélange d'acide acétique, présent dans du vinaigre commercial à une concentration de 5%, et de l'ammoniac. Les deux substances de démarrage ont des odeurs caractéristiques, il est donc possible de savoir pourquoi ce sel sent le vinaigre-ammonia.
Cependant, le plus fort de ce sel n'est pas son odeur, mais son faible point de fusion. Il est si faible que dans n'importe quel laboratoire, il pourrait être obtenu dans sa version liquide, où les ions s'écoulent librement pour transporter les charges électriques.
 Cristaux d'acétate d'ammonium. Source: Vidak [domaine public].
Cristaux d'acétate d'ammonium. Source: Vidak [domaine public]. D'un autre côté, l'acétate d'ammonium est délicieux; c'est-à-dire absorber l'eau ou l'humidité de l'environnement jusqu'à ce qu'il soit complètement dissous. C'est pourquoi, bien qu'à l'état anhydre, leurs cristaux soient blancs, ils deviennent rapidement brillants (comme ceux du bécher de l'image supérieure).
Étant une solide source d'ammoniac, elle doit être manipulée de telle manière que l'inhalation de ses vapeurs soit minimisé. Mais, malgré cette caractéristique négative, le NH4Ch3COOH est utile pour la préparation de solutions tampons que les aliments conservent, tandis qu'il s'agit d'un composant de certains extracteurs de protéines de solvant.
[TOC]
Structure d'acétate d'ammonium
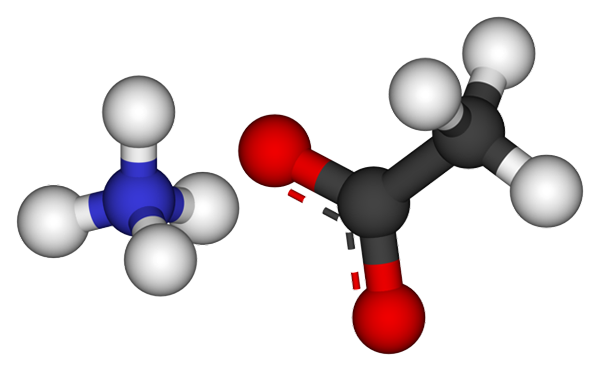 Ions acétate d'ammonium. Source: CCOIL [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)]
Ions acétate d'ammonium. Source: CCOIL [CC BY-SA 3.0 (https: // CreativeCommons.Org / licences / by-sa / 3.0)] L'image supérieure montre les ions qui composent l'acétate d'ammonium dans un modèle de sphères et de barres. À gauche se trouve le cation géométrie tétraédrique, NH4+, Tandis que sur votre droite, l'anion moléculaire avec deux électrons démoqués entre deux atomes d'oxygène, ch3Roucouler- (La ligne pointillée entre les sphères rouges).
Ainsi les deux ions, nh4+ et ch3Roucouler-, Ils restent unis par leur attraction électrostatique qui, avec les répulsions entre les charges égales, finissent par définir un cristal. Ce cristal d'acétate d'ammonium a une structure ortorrombique, qui pourrait être observée dans des échantillons microscopiques ou même des tailles visibles.
Peut vous servir: lien ionique: caractéristiques, comment elle est formée et des exemplesNon seulement la liaison ionique pour ce sel est importante, mais les ponts d'hydrogène aussi. Le NH4+ Vous pouvez faire un don jusqu'à quatre de ces ponts; C'est-à-dire que dans chacun des sommets de son tétraèdre, il y a un atome d'oxygène d'un cho3Roucouler- voisin (h3N+-H-och3).
En théorie, les forces à l'intérieur de leurs cristaux devraient alors être très fortes; Mais expérimentalement l'inverse se produit, car il fond seulement 114 ° C. Par conséquent, les ponts d'hydrogène ne compensent pas la faiblesse de leur liaison ionique, ni la faible énergie réticulaire du verre orthrombique NH4Ch3Roucouler.
Autres compositions et eau
Il a été dit au début que l'acétate d'ammonium est préparé en mélangeant de l'acide acétique et de l'ammoniac. Par conséquent, le sel peut également être exprimé comme: NH3Ch3COOH. Ainsi, selon la composition, d'autres structures peuvent être obtenues: NH3· 2ch3COOH, O NH3· 5ch3COOH, par exemple.
Il a également été mentionné qu'il absorbe suffisamment d'humidité. Ce faisant, il incorpore des molécules d'eau à ses cristaux, qui sont hydrolysés en donnant le NH3 ou ch3COOH; Et c'est pourquoi le sel émet une odeur d'ammoniac ou de vinaigre.
Propriétés
Apparence physique
Cristaux blancs délicats avec une odeur de vinaigre et d'ammoniac.
Masse molaire
77 083 g / mol.
Densité
1 073 g / ml à 25ºC.
Point de fusion
114ºC. Cette valeur est considérablement inférieure par rapport aux autres sels ou composés ioniques. De plus, il n'a pas de point d'ébullition en raison de la formation d'ammoniac, impliquant la décomposition du sel.
Solubilité
143 g / 100 ml à 20 ° C. Notez votre extraordinaire solubilité dans l'eau, qui démontre l'affinité que ressentent les molécules d'eau sur les ions NH4+ et ch3Roucouler-, Les tracer dans des sphères aqueuses.
Peut vous servir: règles de Hume-RotherySa solubilité n'est pas telle dans les solvants moins polaires. Par exemple, dans 100 ml de méthanol à 15 ° C 7,89 g de NH dissolve4Ch3Roucouler.
La stabilité
C'est délicieux, donc vous devriez éviter de stocker dans des espaces humides. De plus, tandis que l'absorption de l'eau libère de l'ammoniac, et donc il décompose.
Pka
9.9.
Cette constante correspond à l'acidité de l'ion ammonium:
NH4+ + B NH3 + HB
Où Hb est un acide faible. Si la base B est l'eau, sa réaction d'hydrolyse sera la réaction:
NH4+ + H2Ou NH3 + H3SOIT+
Dans quelle espèce H3SOIT+ Définir le pH de la solution.
D'un autre côté, l'acétate contribue également au pH:
Ch3Roucouler- + H2Ou ch3COOH + OH-
Ainsi, les deux espèces H3SOIT+ et oh- Ils sont neutralisés en donnant un pH 7, neutre. Cependant, selon PubChem, des solutions hautement concentrées d'acétate d'ammonium ont un pH acide; ce qui signifie que l'hydrolyse NH prédomine4+ À propos du choix3Roucouler-.
Enthalpie de formation standard
ΔFH298 = -615 kJ / mol.
Applications
Analytique
Les solutions aqueuses de l'acétate de sodium permettent de solubiliser le plomb, le fer, le fer et le zinc, pour déterminer par la suite leur concentration par spectroscopie d'absorption atomique.
Demi-conducteur
En tant que repas à basse température par rapport aux autres sels, son liquide peut être utilisé pour conduire le courant électrique qui allume le circuit d'une ampoule.
Amortir
Vous pouvez réguler les changements de pH dans les intervalles acides ou de base, qui est utilisé pour maintenir un pH constant, par exemple, les viandes, les chocolats, les fromages, les légumes ou d'autres produits alimentaires.
Peut vous servir: molybdèneSur la glace et les planchers
Il s'agit d'un sel biodégradable et relativement bon marché, utilisé pour dégicher des chemins glacés. De plus, comme il s'agit d'une source d'azote soluble dans l'eau, il est destiné aux utilisations agricoles pour la détermination des niveaux de potassium.
Agent précipitant
Ce sel est utilisé pour précipiter les protéines pour effectuer une analyse chromatographique.
Médecine
L'acétate d'ammonium fonctionne comme un agent diurétique vétérinaire, et c'est aussi un sel nécessaire pour la synthèse d'insuline et de pénicilline.
Des risques
Suivant et enfin certains risques ou conséquences négatifs causés par l'acétate d'ammonium sont répertoriés:
- Il peut produire de légères irritations sur la peau, mais sans absorber.
- Lorsqu'il est ingéré, provoque l'estomac, la diarrhée, la diurèse, l'anxiété, le besoin d'uriner, les tremblements et autres symptômes liés à l'empoisonnement à l'ammoniac, ainsi que les endommagent le foie.
- Son inhalation irrite le nez, la gorge et les poumons.
Du reste, on ne sait pas si le cancer peut générer et tout risque possible de feu par ce sel est jeté (au moins dans des conditions de stockage normales).
Les références
- Inger Nahringbauer. (1967). Études de liaison hydrogène. Xiv. La structure cristalline de l'acétate d'ammonium. Institut de chimie, Université d'Uppsala, Uppsala, Suède. Cryst ACT. 23, 956.
- Centre national d'information sur la biotechnologie. (2019). Acétate d'ammonium. Base de données PubChem. CID = 517165. Récupéré de: pubchem.NCBI.NLM.NIH.Gouvernement
- Sullivan Randy. (2012). Conductivité de l'acétate d'ammonium. Récupéré de: Chemdemos.Uoregon.Édu
- Viachem, LTD. (s.F.). Acétate d'ammonium. Récupéré de: Viacheminc.com
- Wikipédia. (2019). Acétate d'ammonium. Récupéré de: dans.Wikipédia.org
- Département de la santé du New Jersey. (2012). Acétate d'ammonium: feuille d'information sur les substances dangereuses. [PDF]. Récupéré de: NJ.Gouvernement
- Xueyangu. (s.F.). Utilisations et risques d'acétate d'ammonium. Récupéré de: xueyangu.Wordpress.com
- « Caractéristiques de l'alizarine, préparation, utilisations et toxicité
- Structure de l'hydroxyde de fer (III), propriétés et utilisations »

