Unité Alilo Alilic, carbocation, radical, exemples

- 1809
- 3
- Eva Henry
Il Alilo ou 2-prison est un groupe ou un substituant organique dont la formule structurelle est Cho2= Ch-ch2-. Il se compose d'un fragment de vinyle, ch2= Ch- et un groupe de méthylène, -ch2-. Il se compose d'un groupe d'alcenile, spécifiquement dérivé du propeno, Cho2= Ch-ch3.
Le terme «Alilo» est dû au nom botanique utilisé pour se référer à l'ail: Allium sativum, dont les huiles en 1892 ont été isolées le composé Dialil du disulfure, H2C = chch2Ssch2Ch = ch2, responsable dans une partie de ses odeurs caractéristiques. En fait, de nombreux composés aliliques, c'est-à-dire ceux qui ont le groupe Alilo, se trouvent dans l'ail et les légumes.
 Groupe Alilo
Groupe Alilo L'image supérieure montre la formule squelettique du groupe Alilo. Au-delà des sinuosités à droite, nous avons le reste de la molécule; Si c'est alquilica, il sera représenté avec le symbole R.
Il est facile de reconnaître Alilo car il ressemble beaucoup au groupe vinyle. Cependant, Alilo peut également être cyclique, passant inaperçu dans des composés tels que le cyclope.
Un exemple de composé allylique est l'alcool allié, h2C = chch2Oh. Les hydoogènes du fragment de vinyle peuvent être remplacés et rester un alilo. Ainsi, le 3-méthyl-2-Bunt-1-ol (Cho3)2C = chch2Oh, c'est aussi un alcool allyique. Par conséquent, l'existence d'alilos cycliques est possible.
[TOC]
Unité allyique et ses pièces
Plus important que le groupe Alilo, c'est l'unité allyique qui est la même pour tous les composés alliques. C'est: c = c-c. La fin C = C correspond aux carbones vinyles. Tous les atomes liés à ces deux carbones recevront également le nom de substituants vinyle. Par exemple, s'il s'agit d'hydrogènes, Cho2= Ch, nous parlons d'hydrogènes vinyles.
Pendant ce temps, en revanche, l'extrême -c correspond au carbone allique. Tous les atomes ou groupes liés à ce carbone seront appelés substituants alliques. Par conséquent, les composés allyiques sont précisément tous ceux qui ont un groupe fonctionnel (OH, S, F, COOH, etc.) Lié au carbone allyique.
Peut vous servir: citrate de sodium (C6H5O7NA3): structure, utilisations, propriétésLes carbones vinyles ont une hybridation SP2, Ils sont donc plus électronégatifs que le carbone allyique, SPO3. Cette différence d'électronégativité augmente l'acidité des hydrogènes allyiques, la formation de carbanion allyique étant probable. Mais plus rentable en termes de synthèse organique, c'est le carbocation allylique, qui sera expliqué ci-dessous.
Carbocation
Structures de résonance
 Structures de résonance de carbocation allyique. Source: dissolution / cc by-s (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Structures de résonance de carbocation allyique. Source: dissolution / cc by-s (https: // CreativeCommons.Org / licences / by-sa / 3.0) Dans l'image supérieure, le carbocation allié est affiché. Notez que la charge positive, (+), apparaît d'abord sur le carbone allique. Cependant, immédiatement les électrons à double liaison seront attirés par cette charge, ils se déplaceront donc dans le sens de l'atome de carbone allyique.
Par conséquent, nous avons deux structures de résonance (à gauche de l'image). Maintenant, la charge positive est située sur l'un des carbones en vinyle. Encore une fois, les électrons de la double liaison du côté allique seront à nouveau attirés par la charge positive et reviendront à leur position initiale. Ceci est répété encore et encore, à des vitesses inimaginables.
Le résultat: la charge positive, +1, est déplacée ou dispersée entre les trois atomes de l'unité allique; mais se concentrer uniquement sur les deux carbones des extrémités. Ainsi, l'un des carbones en vinyle conserve une charge de 1/2 +, tandis que Allyl Carbon reste avec l'autre moitié de la charge, ajoutant +1.
Une façon plus appropriée de représenter le carbocation allyique est par son hybride de résonance (droit de l'image). Ainsi, il est observé que la charge positive est distribuée dans toute l'unité allique.
Il peut vous servir: chlorure d'aluminium (ALCL3)Stabilité et distribution de charge positive
La démocation de la charge positive donne une stabilité carbocation allyique. C'est tellement qu'il est assimilé à un carbocation secondaire en termes de stabilité.
Dans l'image, comme ce n'est que l'unité Alllic, il est supposé que la distribution de la charge positive est équivalente aux deux carbones (+1/2 pour chacun). Mais ce n'est pas réalisé pour tous les composés alliques. Ainsi, il y aura des carbocations plus ou moins positives; ce qui signifie qu'ils seront plus ou moins réactifs.
Considérez, par exemple, le cation alilo:
H2C = ch-ch2+ ↔ H2C+-Ch = ch2
Les deux structures de résonance sont équivalentes en distribuant la charge positive. Cela ne se produit pas de la même manière, cependant, avec le cation 1.1-diméthyil:
H2C = ch-c+(Ch3)2 ↔ H2C+-Ch = c (ch3)2
Dans la structure de la gauche, la charge positive est plus stabilisée par la présence des deux groupes méthyle, qui donnent une partie de leur densité de carbone négative.
Pendant ce temps, les hydrogènes en vinyle ne contribuent rien à la charge positive sur le carbone vinyle. Par conséquent, la structure de la gauche contribuera davantage à l'hybride de résonance de ce cation allyique.
Il est crucial de garder à l'esprit que ce sont les hybrides de résonance qui sont les plus proches de l'état réel de ces carbocations, et non leurs structures séparément.
Radical
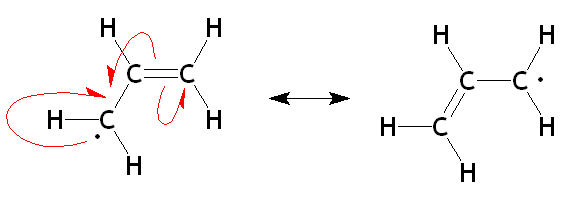 Structures de résonance radicale ALILO. Source: organaute / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0)
Structures de résonance radicale ALILO. Source: organaute / cc by-sa (https: // CreativeCommons.Org / licences / by-sa / 3.0) Dans l'image supérieure, les deux structures de résonance du radical allyique dans son unité allylique respective sont maintenant montrées. Notez que la nature de son développement est la même que pour le carbocation: l'électron disparu (·) est démocalisé entre les deux carbones des extrémités. Par conséquent, chacun aura un «milieu électronique» (1/2 ·).
Peut vous servir: cation: formation, différences avec l'anion et des exemplesCe qui est expliqué pour les carbocations et les aliliques radicaux s'applique également à son carbanion respectif, où chacun des deux atomes de carbone mentionnés aura une demi-charge négative (-1/2).
Exemples de composés aliliques
Ils seront mentionnés pour terminer plusieurs exemples de composés aliliques. Dans chacun d'eux, l'unité allique sera présente:
-Chlorure d'alilo, h2C = ch-ch2-CL
-Sulfure de méthyle allyique, h2C = ch-ch2-S-ch3 (Un autre composé responsable de l'odeur de l'ail)
-Alicina, h2C = ch-ch2-S (o) -s-ch2-Ch = ch2
-Alcool crrotilique, Cho3Ch = ch --ch2Oh (notez que l'un des hydrogènes vinyle est remplacé par un méthyle)
-Alilo acétate, h2C = ch-ch2-Oc (o) ch3
-Bromide Alilo, H2C = ch-ch2-BR
-Alilamina, h2C = ch-ch2-NH2 (Unité de base pour des alimines plus complexes qui sont utilisées comme anti-fungides)
-Pyrophosphate de diméthylalil, (ch3)2C = ch-ch2-Opo2-O-po3
Dans la paire suivante d'alilamines, de la flunarizine et de la naphfine, à la fois avec des effets pharmacologiques, nous pouvons apprécier le groupe Alilo:
 Formules structurelles de deux alimines. Source: HBF878 / CC0.
Formules structurelles de deux alimines. Source: HBF878 / CC0. Dans les deux, c'est à droite: cette double liaison a été déposée entre les anneaux de pipérazine (l'hexagonal avec deux atomes d'azote) et le benzène. Notez que pour identifier l'Alilo, c'est essentiel.
Les références
- Morrison, R. T. Et Boyd, R, n. (1987). Chimie organique. 5e édition. Éditorial Addison-Wesley Inter-American.
- Carey F. (2008). Chimie organique. (Sixième édition). Mc Graw Hill.
- Graham Salomons t.W., Craig B. Fryhle. (2011). Chimie organique. (10e édition.). Wiley Plus.
- Wikipédia. (2020). Groupe d'allyle. Récupéré de: dans.Wikipédia.org
- Elsevier B.V. (2020). Composé allyle. ScienceDirect. Récupéré de: ScienceDirect.com
- Gamini Gunawardena. (5 juin 2019). Carbone allylique. CHIMISTER BOOLISTexts. Récupéré de: Chem.Bibliothèque.org
- « Caractéristiques des coûts historiques, avantages, inconvénients, exemples
- Concept de références croisées, fonctions, exemples »

