Caractéristiques d'Alfa Amilasa, structure, fonctions
- 3617
- 271
- Jade Duval
La Alfa Amilasa (α-amylase) est une enzyme amilolithique du groupe Endo Amilasas qui est responsable de l'hydrolyse des liaisons α-1,4 entre les résidus de glucose qui constituent différents types de glucides dans la nature.
Systématiquement connu sous le nom de α-1,4-gluan. Chez l'homme, par exemple, les amylases présentes dans la salive et celles sécrétées par le pancréas sont de type α-amylases.
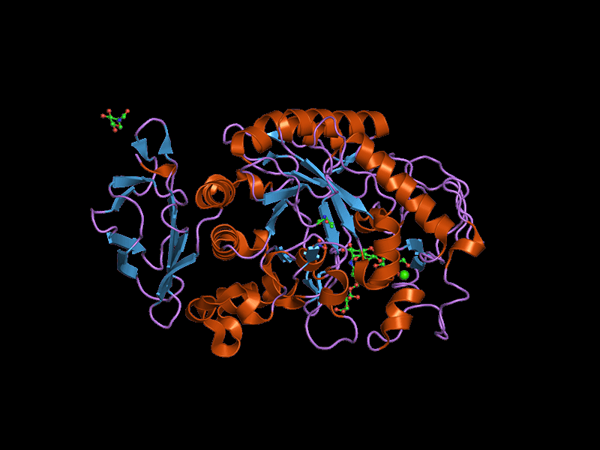
 Structure du domaine C-terminal de l'animal Alfa Amilasa (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons) via Wikimedia Commons)
Structure du domaine C-terminal de l'animal Alfa Amilasa (Source: Jawahar Swaminathan et MSD Staff de l'Institut européen de bioinformatique [Domaine public] via Wikimedia Commons) via Wikimedia Commons) Kuhn, en 1925, a été le premier à inventer le terme "α-amylase" en fonction du fait que les produits d'hydrolyse qui catalysent ces enzymes ont une configuration α. Plus tard, en 1968, il a été déterminé que ceux-ci agissent de préférence sur des substrats de configuration structurelle linéaires et non branchés.
Comme d'autres enzymes amilolithiques, l'α-amylase est responsable de l'hydrolyse de l'amidon et d'autres molécules apparentées telles que le glycogène, produisant des polymères plus petits composés d'unités répétées de glucose.
En plus des fonctions physiologiques que cette enzyme a chez les animaux, les plantes et les micro-organismes qui l'expriment, l'α-amylase, ainsi que les autres classes d'amylases existantes, représentent 25% des enzymes utilisées à des fins industrielles et biotechnologiques.
De nombreuses espèces de champignons et de bactéries sont la principale source d'obtention des α-amylases qui sont utilisées plus fréquemment dans l'industrie et l'expérimentation scientifique. Cela est principalement dû à sa polyvalence, à son objet facile, à sa gestion simple et aux faibles coûts liés à sa production.
[TOC]
Caractéristiques
Les α-amylases trouvées dans la nature peuvent avoir des plages de pH optimales de pH très différent pour son fonctionnement; Par exemple, optimal pour les animaux α-amylases et la plante se situe entre 5.5 et 8.0 unités de pH, mais certaines bactéries et champignons ont plus d'enzymes alcalines et plus d'acides.
Peut vous servir: phylogénieLes enzymes présentes dans la salive et le pancréas de mammifères fonctionnent mieux à un pH près de 7 (neutre) en outre, ils nécessitent des ions de chlorure pour atteindre leur activité enzymatique maximale et sont capables de rejoindre les ions calcium divalents.
Les deux animaux, les enzymes salivaires et pancréatiques sont produits dans les organismes par des mécanismes indépendants qui impliquent des cellules et des glandes spécifiques et qui ne sont probablement pas liés aux enzymes présentes dans le torrent circulatoire et d'autres cavités corporelles.
Le pH et la température optimale pour le fonctionnement de ces enzymes dépend grandement de la physiologie de l'organisme qui est considérée, car il existe des micro-organismes extrémophiles qui se développent dans des conditions très particulières par rapport à ces paramètres et à bien d'autres.
Enfin, en termes de régulation de son activité, une caractéristique partagée entre les enzymes du groupe d'α-amylas.
Structure
L'α-amylase est une enzyme multidominium qui, chez les animaux et les plantes, a un poids moléculaire approximatif de 50 kDa et que différents auteurs conviennent que les enzymes appartenant à cette famille de glycohydrolese sont des enzymes avec plus de domaines structurels.
Le domaine central ou le domaine catalytique est très préservé et est connu sous le nom de domaine A, qui consiste en un pli symétrique de 8 feuilles plaquées β disposées sous la forme d'un «baril» entouré de 8 salles alpha, vous pouvez donc également trouver Dans la littérature comment (β / α) 8 ou baril de type "TIM".
Il est important de noter qu'à l'extrémité C-terminale des feuilles β du domaine A se trouvent les déchets d'acides aminés préservés impliqués dans la catalyse et dans la jonction du substrat et que ce domaine est situé dans la région N-terminale de la protéine.
Il peut vous servir: faune et flore de la mer péruvienneUn autre des domaines les plus étudiés de ces enzymes est le soi-disant ding b, qui se démarque entre la lame β-peale et l'hélice alpha numéro 3 du domaine A. Cela joue un rôle fondamental dans l'union du substrat et du calcium divalent.
Des domaines supplémentaires ont été décrits pour les enzymes α-amylasse, tels que les domaines C, D, F, G, H et H, qui sont situés à l'avant ou à l'arrière du domaine A et dont les fonctions ne sont pas connues exactement et dépendent de l'organisme qui Il est étudié.
α-amylases de micro-organismes
Le poids moléculaire des α-amylases dépend, ainsi que d'autres caractéristiques biochimiques et structurelles, sur l'organisme étudié. Ainsi, les α-amylases de nombreux champignons et bactéries ont des poids aussi bas que 10 kDa et aussi élevés que 210 kDa.
Le poids moléculaire élevé de certaines de ces enzymes microbiennes est souvent lié à la présence de glycosilation, bien que la glycosylation des protéines chez les bactéries soit assez rare.
Les fonctions
Chez les animaux, les α-amylases sont responsables des premières étapes du métabolisme de l'amidon et du glycogène, car ils sont responsables de leur hydrolyse de fragments plus petits. Les organes du système gastro-intestinal chargé de leur production chez les mammifères sont le pancréas et les glandes salivaires.
En plus de sa fonction métabolique évidente, la production d'α-amylases produites par les glandes salivaires de nombreux mammifères, activées par l'action de la norépinéphrine, est considérée par de nombreux auteurs comme un marqueur de stress "psychobiologique" important dans le stress dans le système nerveux central.
Il a également des fonctions secondaires en santé bucco-dentaire, car son activité fonctionne dans l'élimination des bactéries orales et dans la prévention de son adhérence aux surfaces orales.
Il peut vous servir: Spéciation sympatrique: concept, caractéristiques et exemplesFonction principale dans les plantes
Chez les plantes, les α-amylases jouent un rôle principal dans la germination des graines, car ce sont les enzymes qui hydrolysent l'amidon présent dans l'endosperme qui nourrit l'embryon à l'intérieur, procédé essentiellement contrôlé par la gibbereline, une phytormonie.
Applications industrielles
Les enzymes appartenant à la famille des α-amylases ont plusieurs applications dans de nombreux contextes différents: industriel, scientifique et biotechnologique, etc.
Dans les grandes industries de transformation d'amidon, les α-amylases sont populairement utilisées pour la production de glucose et de fructose, ainsi que pour la production de pain avec des textures améliorées et avec une plus grande capacité fidèle.
Dans le domaine biotechnologique, il existe beaucoup d'intérêt concernant l'amélioration des enzymes utilisées commercialement, afin d'améliorer leur stabilité et leur performance dans différentes conditions.
Les références
- Aiyer, p. V. (2005). Amylases et leurs applications. Journal africain de biotechnologie, 4(13), 1525-1529.
- Bernfeld, P. (1960). Amylases, A et B. Dans Enzymes du métabolisme des glucides (Vol. Moi, pp. 149-158).
- Granger, D. POUR., Kivighan, k. T., Eux., Gordis, E. B., & Stud, L. R. (2007). Salivaire A-and-lid in BioBehavioral Research. Développements et applications récentes. Ann. N.ET. Acade. SCI., 1098, 122-144.
- Monteiro, P., & Oliveira, p. (2010). Application de la Microbial A-and-lid dans l'industrie - une revue. Journal brésilien de microbiologie, 41, 850-861.
- Reddy, n. S., Nimmagadda, un., & Rao, k. R. S. S. (2003). Un aperçu de la famille des aim-amour microbiens. Journal africain de biotechnologie, 2(12), 645-648.
- Sel, w., & Shenker, S. (1976). Amylase - sa signification clinique: une revue de la littérature. Médecine, 55(4), 269-289.
- Svensson, B., & Macgregor, et. POUR. (2001). Relation de séquence et de structure à la spécificité de la famille des enzymes A-amylase. Biochimica et biophysica acta, 1546, 1-20.
- Thoma, J. POUR., Spradlin, J. ET., & Dygert, s. (1925). Amylases végétales et animales. Ann. Chem., 1, 115-189.
- « Structure rénine, production, sécrétion, fonctions
- Biographie d'Urie Bronfenbrenner, modèle écologique et contributions »

